本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
CANDLE試驗的最新亞分析顯示,Canagliflozin在治療2型糖尿病和慢性心臟衰竭患者時,對心臟左室舒張功能有正面影響。這種SGLT2抑制劑尤其在左心室舒張功能較差的患者群中,展現了減少NT-proBNP水平的趨勢,暗示其在不同亞型患者中的療效或有所差異。
Canagliflozin對2型糖尿病和慢性心臟衰竭患者中心臟左室舒張功能分層的NT-proBNP的影響:CANDLE試驗的亞分析
Effects of canagliflozin on NT-proBNP stratified by left ventricular diastolic function in patients with type 2 diabetes and chronic heart failure: a sub analysis of the CANDLE trial
Kenya Kusunose, Takumi Imai, Atsushi Tanaka, Kaoru Dohi, Kazuki Shiina, Takahisa Yamada, Keisuke Kida, Kazuo Eguchi, Hiroki Teragawa, Yasuchika Takeishi, Nobuyuki Ohte, Hirotsugu Yamada, Masataka Sata, Koichi Node on behalf of CANDLE Trial Investigators
https://cardiab.biomedcentral.com/articles/10.1186/s12933-021-01380-w
摘要
背景:
確定心臟衰竭(HF)有效的治療亞型是優化該疾病治療的關鍵課題。我們假設SGLT2抑制劑(SGLT2i)對N-末端前腦利尿激素(NT-proBNP)水平的有益效果可能取決於基線的舒張功能。為了闡明SGLT2i在2型糖尿病(T2DM)和慢性HF中的效果,我們進行了CANDLE試驗的事後亞研究,研究了canagliflozin對基線至24週的NT-proBNP水平的影響,並根據基線時左心室(LV)的舒張功能對數據進行了分層。
方法:
CANDLE試驗中的患者(n = 233)隨機分配到添加canagliflozin(n = 113)或glimepiride治療組(n = 120)。主要終點是比較從基線到24週的NT-proBNP水平的變化,根據基線心室舒張功能進行分層。
結果
從基線到24週,canagliflozin組的NT-proBNP平均水平變化為0.98 (95% CI 0.89–1.08),而glimepiride組為1.07 (95% CI 0.97–1.18)。canagliflozin和glimepiride的變化比率為0.93 (95% CI 0.82–1.05)。應答者分析被用來研究NT-proBNP水平改善的反應。儘管關於室間隔環速度(SEP-e′)的亞組分析顯示治療效果沒有明顯的異質性,但SEP-e′ < 4.7 cm/s的亞組顯示canagliflozin組與glimepiride組相比,NT-proBNP水平較低(canagliflozin和glimepiride的變化比率為0.83,95% CI 0.66–1.04)。
結論
在左心室舒張功能較差的亞組中,canagliflozin與glimepiride相比,顯示了減少NT-proBNP水平的趨勢。這項研究暗示,canagliflozin治療的有益效果可能在根據左心室舒張功能障礙的嚴重性分類的亞組中有所不同。
Abstract
Background
Identification of the effective subtypes of treatment for heart failure (HF) is an essential topic for optimizing treatment of the disorder. We hypothesized that the beneficial effect of SGLT2 inhibitors (SGLT2i) on the levels of N-terminal pro-brain natriuretic peptide (NT-proBNP) might depend on baseline diastolic function. To elucidate the effects of SGLT2i in type 2 diabetes mellitus (T2DM) and chronic HF we investigated, as a post-hoc sub-study of the CANDLE trial, the effects of canagliflozin on NT-proBNP levels from baseline to 24 weeks, with the data stratified by left ventricular (LV) diastolic function at baseline.
Methods
Patients (n = 233) in the CANDLE trial were assigned randomly to either an add-on canagliflozin (n = 113) or glimepiride treatment groups (n = 120). The primary endpoint was a comparison between the two groups of the changes from baseline to 24 weeks in NT-pro BNP levels, stratified according to baseline ventricular diastolic function.
Results
The change in the geometric mean of NT-proBNP level from baseline to 24 weeks was 0.98 (95% CI 0.89–1.08) in the canagliflozin group and 1.07 (95% CI 0.97–1.18) in the glimepiride group. The ratio of change with canagliflozin/glimepiride was 0.93 (95% CI 0.82–1.05). Responder analyses were used to investigate the response of an improvement in NT-proBNP levels. Although the subgroup analyses for septal annular velocity (SEP-e′) showed no marked heterogeneity in treatment effect, the subgroup with an SEP-e′ < 4.7 cm/s indicated there was an association with lower NT-proBNP levels in the canagliflozin group compared with that in the glimepiride group (ratio of change with canagliflozin/glimepiride (0.83, 95% CI 0.66–1.04).
Conclusions
In the subgroup with a lower LV diastolic function, canagliflozin showed a trend of reduced NT-pro BNP levels compared to that observed with glimepiride. This study suggests that the beneficial effects of canagliflozin treatment may be different in subgroups classified by the severity of LV diastolic dysfunction.
導言
大型臨床試驗中患有2型糖尿病(T2DM)的患者報告,鈉-葡萄糖共轉運蛋白-2抑制劑(SGLT2i)改善了心血管結果,特別是心臟衰竭(HF)住院的風險[1,2,3]。此外,針對T2DM患者的這些大型試驗的meta分析也顯示SGLT2i降低了因HF住院的風險[4]。但是,這些試驗中只有少數患有慢性HF的患者,並且沒有檢查他們的HF型態。在臨床指南中,根據症狀和以射血分數(EF)劃分的心臟收縮功能,通常將HF型態分類[5]。對於伴有減少的EF的HF患者(HFrEF),神經激素拮抗劑可以減少心血管事件的風險。但是,這些已建立的HFrEF治療在伴有保存的EF的HF(HFpEF)的試驗中沒有顯示出效果[6,7]。最近,一些研究者報告高級成像可以識別治療有效的亞型[8, 9]。在這一研究領域的新進展是利用人工智能使用多種組學數據進行詳細的表型分類,從而使得能夠對早期疾病進行分層和評估預後[10, 11]。因此,確定HF治療的有效亞型是為了最佳化HF治療的重要研究主題[12]。
我們進行了一項隨機試驗,比較了SGLT2i,canagliflozin和glimepiride的治療,主要目的是評估canagliflozin對患有慢性HF的T2DM患者的N-末端前腦利尿肽(NT-proBNP)水平的影響[13]。這項研究在使用canagliflozin與glimepiride治療24週後沒有達到預定的主要終點(NT-proBNP水平的百分比變化的組比率的非劣效性)。有趣的是,由canagliflozin治療引起的NT-proBNP水平的降低在HFpEF中比在HFrEF中更為明顯。因此,我們假設NT-proBNP的效果可能取決於基線心功能。為了闡明SGLT2i在T2DM中的效果,我們研究了canagliflozin對NT-proBNP水平的影響,並按照CANDLE試驗的子研究的基線左心室舒張功能進行了分層。
方法
這是CANDLE試驗(UMIN000017669)的事後分析。CANDLE研究設計的詳細資訊已在其他地方發表[14]。簡單來說,這項研究是在日本的34所機構進行的多中心、隨機、前瞻性、開放標籤、盲端點試驗。每個參與機構的倫理委員會批准了研究方案,並從所有受試者那裡獲得了書面的知情同意參加研究。在排除不合格的患者後,於2015年8月至2017年6月之間,在該研究中隨機選取了245名患有T2DM和慢性HF的患者。患者按1:1的比例隨機分配為增加canagliflozin治療(canagliflozin組,n = 122)或glimepiride治療(glimepiride組,n = 123)。在排除未同意參加研究、中止治療或有嚴重方案偏差的患者後,分別有113和120名患者接受canagliflozin或glimepiride治療,並包括在分析數據集中(圖1)。CANDLE研究的主要終點是治療隨機分配後24週的NT-proBNP水平的變化。在基線時進行心動超聲檢查(canagliflozin組,n = 105,以及glimepiride組,n = 112),並使用結果將患者分層為子組進行數據分析。
圖1患者選擇過程的流程圖
心臟超聲波評估
採用標準方式執行心臟超聲波檢查,使用商用超聲診斷機器,在各機構測量各種血流動力學參數。按照美國心臟超聲檢查學會[15]發布的指南執行記錄和測量。從頂部雙腔和四腔視角測量左心室射血分數(LVEF)並使用雙平面磁盤方法進行計算。從頂部長軸或四腔視角記錄傳導二尖瓣流速(TMF)。測量早期舒張速度峰值(E)。從四腔頂視角記錄二尖瓣環運動速度模式,樣品體積位於二尖瓣環的中隔側,使用脈衝組織多普勒超聲心動圖進行測量。測量早期舒張速度(e’)的峰值,然後計算E和e′的比率(E/e′)。這些速度參數用作左心室舒張功能的標記。
實驗室檢查
在基線和12及24個月後採集血液樣本。在集中化的實驗室(SRL Co. 東京, 日本)使用電化學發光免疫分析法(ECLIA)和散射測定法測量NT-proBNP的血清水平。
統計分析
基線特徵使用頻率和百分比表示類別變量,並使用均值和標準偏差表示連續變量。使用標準化差異(std diff)評估兩組間基線特徵的機會不平衡,其值 < 0.2表示組間平衡良好。所有統計分析都根據意圖治療原則進行。對於隨訪HbA1c水平的評估,分析使用了線性混合模型並調整了基線值。繪製了兩組在4、12和24週的均值及95%置信區間(CI),然後進行比較。NT-proBNP分析使用了對數尺度的線性模型,並調整了基線值。計算了兩個治療組從基線到24週的幾何均值和95% CI的變化,以及兩個治療組在24週的幾何均值比率。為了檢查治療效果在SEP-e′和E/SEP-e′的值之間的一致性,進行了兩種分析。在第一次分析中,對所有病人在基線時SEP-e′或E/SEP-e′值的三分之一進行了亞組分析。在第二次分析中,SEP-e′或E/SEP-e′的值被包括在24週的NT-proBNP模型中,使用了限制的立方脊函數。對SEP-e′或E/SEP-e′的值繪製了兩個治療組的幾何均值的估計變化。所有分析都使用了R軟件,版本3.6.3(R統計計算基金會)。統計顯著性被定義為p值 < 0.05。
結果
基線臨床特徵
Canagliflozin和對照組的基線臨床特徵顯示在表1中。兩組中約有40%的患者患有高血壓,兩組的血壓均受到良好控制。在基線時,兩組之間在檢查的任何變量中都沒有顯著差異,唯一的例外是心率,在canagliflozin組中略高於glimepiride組(標準化差異 = 0.226)。所有患者在基線時的1/3和2/3百分位數分別為SEP-e′的4.7 cm/s和6.4 cm/s,以及E/SEP-e′的10.2和13.9。這些值定義的每個亞組中的患者數量描述在表2中。缺少SEP-e′或E/SEP-e′數據的患者被排除在亞組分析之外。
表1 兩個治療組患者的臨床特徵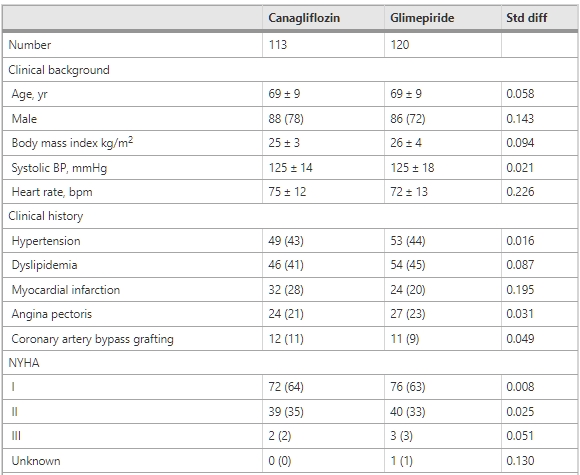

Canagliflozin和對照組的基線臨床特徵顯示在表1中。兩組中約有40%的患者患有高血壓,兩組的血壓均受到良好控制。在基線時,兩組之間在檢查的任何變量中都沒有顯著差異,唯一的例外是心率,在canagliflozin組中略高於glimepiride組(標準化差異 = 0.226)。所有患者在基線時的1/3和2/3百分位數分別為SEP-e′的4.7 cm/s和6.4 cm/s,以及E/SEP-e′的10.2和13.9。這些值定義的每個亞組中的患者數量描述在表2中。缺少SEP-e′或E/SEP-e′數據的患者被排除在亞組分析之外。

請參見表1中的縮寫。
圖2顯示了研究期間HbA1c的變化。在glimepiride組中觀察到更大的HbA1c水平降低(主要效果的P值= 0.048 和與時間的交互作用的P值 = 0.017)。在canagliflozin組和glimepiride組,最終的HbA1c水平分別為6.93 mg/dL和6.73 mg/dL。
圖2在兩個治療組中,於4、12和24周時的HbA1c變化。
NT-proBNP水平的影響
在基線時,canagliflozin組的NT-proBNP水平的幾何平均數為217.4(95% CI 169.3–279.1),而glimepiride組的數值為211.8(95% CI 166.4–269.6)。在24周時,canagliflozin組的NT-proBNP水平的幾何平均數為212.8(95% CI 165.5–273.5),而glimepiride組的數值為225.8(95% CI 177.2–287.8)。從基線到24周的變化,在canagliflozin組是0.98(95% CI 0.89–1.08),在glimepiride組是1.07(95% CI 0.97–1.18)(圖3A)。canagliflozin/glimepiride的變化比率是0.93(95% CI 0.82–1.05)。
圖3基線至24周間NT-proBNP的幾何平均數的變化,按septal e′ (SEP-e′)分層,在兩個治療組中。A 由SEP-e′的三分位數定義的三組。B 使用原始SEP-e′值的線性模型,帶有限制的立方樣條函數。
子組分析的結果摘要於表3中,並在圖3A和圖4A中繪製。觀察到的治療效果並無明顯的異質性。
表3 每個子組中NT-proBNP的幾何平均數變化
GM: 幾何平均數
請參閱表1中的縮寫說明
從基線到24週按E/e′分層的兩個治療組的NT-proBNP幾何均值的變化。A 由E/SEP-e′的三分位數定義的三個組。B 使用限制的立方樣條函數的原始E/SEP-e′值的線性模型。
在按SEP-e′值的三分位數定義的亞組中,SEP-e′的第一三分位數(< 4.7 cm/s)似乎與canagliflozin組中較低的NT-proBNP水平相關,與glimepiride組中觀察到的值相比(canagliflozin/glimepiride的變化比例:0.83,95% CI 0.66–1.03)。儘管這種差異在統計學上並不顯著,但在使用原始SEP-e′值的線性模型中也暗示了相同的趨勢(見圖3B)。
在按E/SEP-e′值的三分位數定義的亞組中,E/SEP-e′的第三三分位數(≥ 13.9)也似乎與canagliflozin組中較低的NT-proBNP水平相關,與glimepiride組中觀察到的值相比(canagliflozin/glimepiride的變化比例:0.95,95% CI 0.74–1.22)。儘管這種差異在統計學上並不顯著,但在使用原始E/SEP-e′值的線性模型中也觀察到了相同的趨勢(見圖4B)。
討論
此研究是CANDLE試驗的子研究,評估了canagliflozin在從基線到24週按左心室舒張功能分層的NT-proBNP水平上的影響。這項前瞻性、隨機研究為我們對SGLT2i對NT-proBNP的影響提供了新的見解。我們觀察到,在有舒張功能障礙的患者(e′降低和E/e′升高)中,canagliflozin治療傾向於比glimepiride更大程度地降低NT-proBNP水平。這項研究的結果可能有助於識別SGLT2i更有效的心衰亞型,因此值得進一步研究。
SGLT2i對NT-proBNP的機制
許多研究者已經證明,由於多種途徑的改變,SGLT2i提供了有益的心血管效果[16, 17]。此現象的幾個潛在機制為:(1) SGLT2i的利尿作用,(2) 超酮血症使心肌燃料使用從葡萄糖切換到酮體和自由脂肪酸,從而產生更高效的ATP生產[18],以及(3) SGLT2i抑制心臟Na+-H+交換器(NHE),從而減少細胞內鈣並增加粒線體Ca2+,這恢復了粒線體功能和氧化還原狀態,並啟動ATP生產[19]。通過動物模型的研究結果獲得了這些潛在機制的支持,例如使用SGLT2i減少糖尿病小鼠心臟的氧化應激和纖維化,或在預糖尿病小鼠模型中改善冠狀動脈微血管功能和心臟收縮性[20, 21]。基於這些有益的心血管效果,使用SGLT2i似乎可以降低NT-proBNP水平。少數隨機臨床試驗已經研究了SGLT2i對NT-proBNP水平的影響,作為治療對HF的影響的指標[22]。最近,使用dapagliflozin 12週並未影響HFrEF患者的NT-proBNP水平,儘管它增加了在心衰相關健康狀態或利尿激素水平上經歷臨床有意義改善的患者比例[23]。因此,SGLT-2i對NT-proBNP的影響仍然存在爭議,需要識別更多有效的亞型。
SGLT2i在HF亞型中的影響
長期以來,人們認識到心血管藥物在HFrEF患者中的效果已經得到確定,但在HFpEF患者中尚未確定。因此,在HF領域中,確定這些藥物有用的亞型是一個重要的臨床問題。多項分析顯示,預HFrEF狀態和HF中範圍EF患者的預後較好,當使用指南中推薦的治療方法時,與HFrEF患者相似[24, 25]。從這個角度看,在亞臨床心肌功能障礙的患者中使用心臟保護藥物可能對心血管功能有更大的有益效果,與正常心臟功能的患者相比。此外,儘管沒有明顯的結構性心臟疾病或心衰症狀,糖尿病患者被認為是“A期心衰”,因為他們的心衰風險增加[26]。這些患者經常表現出亞臨床心肌功能障礙,這可以通過存在舒張功能障礙和LV肥厚來診斷[27]。亞臨床LV功能障礙可能是SGLT2i效果的關鍵指標。在我們的研究中,canagliflozin治療傾向於在LV舒張功能障礙的患者中比glimepiride更大程度地降低NT-proBNP水平。這些發現表明,LV舒張功能受損的患者也可能從SGLT2i的使用中受益。這一發現可能為根據HF表型對SGLT2i的效果提供深入的見解。
對NT-proBNP的影響在之前的研究中已經被檢查,但結果仍有爭議。一種可能的解釋是,SGLT2i的效果也取決於基線時的心臟功能,因為包括β-受體阻滯劑和renin–angiotensin–aldosterone系統抑制劑在內的心臟保護藥物的效果取決於EF,而HF指南推薦了基於EF的治療策略。儘管最近的一項荟萃分析顯示,對T2DM患者進行SGLT2i治療與血漿NT-proBNP濃度的顯著改善有關,無論是否存在HF,但LVEF水平只在HFrEF中得到改善[28]。在這種情境下,我們需要進一步評估心超參數來預測SGLT2i的心血管有益效果。我們的研究是首次建議基線舒張功能可能在預測SGLTi對血漿NT-proBNP的效果中起到重要作用。
已發現Dapagliflozin與改善左心室(LV)長軸心肌功能相關,從而改善了穩定心衰(HF)的T2DM患者的LV舒張功能[29]。其有益效果可能針對冠狀動脈內皮[30]。此外,empagliflozin在非糖尿病HF豬模型中改善了舒張功能,減輕了組織和分子重塑,並減少了LV和心肌細胞的僵硬度[31]。因此,其他SGLT2抑制劑可能具有與本文中描述的相似效果。
臨床意義
雖然有越來越多的證據表明SGLT2i對HF有益,但尚未詳細檢查哪種心臟功能的特徵可以確定哪些患者群體將受益於SGLT2i的治療。舒張功能障礙可能是識別T2DM中NT-proBNP水平有益影響的好指標。不幸的是,儘管進一步的試驗可能會顯示這種關係,但在目前的研究中,我們未能顯示舒張功能障礙和NT-proBNP水平改善之間存在強烈的關聯。
限制
這項研究是CANDLE研究的次級分析,並且並未在所有受試者中進行超聲心動圖檢查。因此,研究對象的數量相對較小,且僅包括日本患者。此研究是對CANDLE試驗的事後分析,該試驗並未特別設計或提供足夠的能力來根據基線的超聲心動圖資料進行亞組分析。雖然已有幾項針對HF的臨床試驗使用這種方法分析NT-proBNP濃度,評估介入對NT-proBNP濃度作為HF治療的替代終點的影響[32, 33],但關於測量利尿激素是否足以確定具有臨床意義的治療效果仍存在爭議[34, 35]。未來的研究應處理與HF相關的健康狀態的多個參數。在最近的美國心臟超聲學會/歐洲心血管影像學會(ASE/EACVI)建議[15]中,使用左心房體積指數和三尖瓣迴流峰值速度評估舒張功能障礙。但是,此次試驗旨在收集有限的超聲心動圖變量(TMF-E、SEP-e′、E/e′和EF),因此我們在這項研究中只使用了這些變量。儘管參與者的背景治療原則上(如果可能的話)在試驗期間將保持不變,但其他藥物可能會在本研究中影響NT-proBNP。不幸的是,我們在研究期間沒有收集藥物修改的詳細資料。
結論
據我們所知,這是第一個前瞻性的隊列研究,建議canagliflozin治療的有益效果可以根據LV舒張功能障礙進行分層,以HF的亞型為不同。
資料和材料的可用性
當前研究分析的數據集可以從相應的作者那裡合理地要求獲得(通過candle-sub@clin-med.org聯繫)。
縮寫
T2DM:2型糖尿病
SGLT2i:鈉-葡糖共轉運蛋白-2抑制劑
HFrEF:射血分數降低的心力衰竭
HFpEF:保存射血分數的心力衰竭
NT-proBNP:N-末端前腦利尿激素
參考文獻
-
Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, Mattheus M, Devins T, Johansen OE, Woerle HJ. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med. 2015;373(22):2117–28.
-
Neal B, Perkovic V, Mahaffey KW, De Zeeuw D, Fulcher G, Erondu N, Shaw W, Law G, Desai M, Matthews DR. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med. 2017;377(7):644–57.
-
Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, Silverman MG, Zelniker TA, Kuder JF, Murphy SA. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2019;380(4):347–57.
-
Zelniker TA, Wiviott SD, Raz I, Im K, Goodrich EL, Bonaca MP, Mosenzon O, Kato ET, Cahn A, Furtado RH. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet. 2019;393(10166):31–9.
-
Tsutsui H, Isobe M, Ito H, Ito H, Okumura K, Ono M, Kitakaze M, Kinugawa K, Kihara Y, Goto Y, et al. JCS 2017/JHFS 2017 guideline on diagnosis and treatment of acute and chronic heart failure- digest version. Circ J. 2019;83(10):2084–184.
-
Young JB, Dunlap ME, Pfeffer MA, Probstfield JL, Cohen-Solal A, Dietz R, Granger CB, Hradec J, Kuch J, McKelvie RS. Mortality and morbidity reduction with Candesartan in patients with chronic heart failure and left ventricular systolic dysfunction: results of the CHARM low-left ventricular ejection fraction trials. Circulation. 2004;110(17):2618–26.
-
Solomon SD, Claggett B, Lewis EF, Desai A, Anand I, Sweitzer NK, O’meara E, Shah SJ, McKinlay S, Fleg JL. Influence of ejection fraction on outcomes and efficacy of spironolactone in patients with heart failure with preserved ejection fraction. Eur Heart J. 2016;37(5):455–62.
-
Verdonschot JA, Merken JJ, Brunner-La Rocca H-P, Hazebroek MR, Eurlings CG, Thijssen E, Wang P, Weerts J, van Empel V, Schummers G. Value of speckle tracking–based deformation analysis in screening relatives of patients with asymptomatic dilated cardiomyopathy. Cardiovascular Imaging. 2020;13(2_Part_2):549–58.
-
Halliday BP, Senior R, Pennell DJ. Assessing left ventricular systolic function: from ejection fraction to strain analysis. Eur Heart J. 2021;42(7):789–97.
-
Bayes-Genis A, Liu PP, Lanfear DE, de Boer RA, González A, Thum T, Emdin M, Januzzi JL. Omics phenotyping in heart failure: the next frontier. Eur Heart J. 2020;41(36):3477–84.
-
Gladding PA, Loader S, Smith K, Zarate E, Green S, Villas-Boas S, Shepherd P, Kakadiya P, Hewitt W, Thorstensen E. Multiomics, virtual reality and artificial intelligence in heart failure. Future Cardiol. 2021. https://doi.org/10.2217/fca-2020-0225.
-
De Keulenaer GW, Brutsaert DL. Systolic and diastolic heart failure are overlapping phenotypes within the heart failure spectrum. Circulation. 2011;123(18):1996–2004 (discussion 2005).
-
Tanaka A, Hisauchi I, Taguchi I, Sezai A, Toyoda S, Tomiyama H, Sata M, Ueda S, Oyama J, Kitakaze M. Effects of canagliflozin in patients with type 2 diabetes and chronic heart failure: a randomized trial (CANDLE). ESC Heart Fail. 2020;7(4):1585–94.
-
Tanaka A, Inoue T, Kitakaze M, Oyama J, Sata M, Taguchi I, Shimizu W, Watada H, Tomiyama H, Ako J. Rationale and design of a randomized trial to test the safety and non-inferiority of canagliflozin in patients with diabetes with chronic heart failure: the CANDLE trial. Cardiovasc Diabetol. 2016;15(1):1–11.
-
Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, Ernande L, Flachskampf FA, Foster E, Goldstein SA, Kuznetsova T, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2015;28(1):1–39.
-
Verma S, McMurray JJ. SGLT2 inhibitors and mechanisms of cardiovascular benefit: a state-of-the-art review. Diabetologia. 2018;61(10):2108–17.
-
Packer M, Butler J, Filippatos GS, Jamal W, Salsali A, Schnee J, Kimura K, Zeller C, George J, Brueckmann M. Evaluation of the effect of sodium–glucose co-transporter 2 inhibition with empagliflozin on morbidity and mortality of patients with chronic heart failure and a reduced ejection fraction: rationale for and design of the EMPEROR-Reduced trial. Eur J Heart Fail. 2019;21(10):1270–8.
-
Mudaliar S, Polidori D, Zambrowicz B, Henry RR. Sodium–glucose cotransporter inhibitors: effects on renal and intestinal glucose transport: from bench to bedside. Diabetes Care. 2015;38(12):2344–53.
-
Baartscheer A, Schumacher CA, Wüst RC, Fiolet JW, Stienen GJ, Coronel R, Zuurbier CJ. Empagliflozin decreases myocardial cytoplasmic Na+ through inhibition of the cardiac Na+/H+ exchanger in rats and rabbits. Diabetologia. 2017;60(3):568–73.
-
Adingupu DD, Göpel SO, Grönros J, Behrendt M, Sotak M, Miliotis T, Dahlqvist U, Gan L-M, Jönsson-Rylander A-C. SGLT2 inhibition with empagliflozin improves coronary microvascular function and cardiac contractility in prediabetic ob/ob−/− mice. Cardiovasc Diabetol. 2019;18(1):1–15.
-
Li C, Zhang J, Xue M, Li X, Han F, Liu X, Xu L, Lu Y, Cheng Y, Li T. SGLT2 inhibition with empagliflozin attenuates myocardial oxidative stress and fibrosis in diabetic mice heart. Cardiovasc Diabetol. 2019;18(1):1–13.
-
Januzzi JL, Butler J, Jarolim P, Sattar N, Vijapurkar U, Desai M, Davies MJ. Effects of canagliflozin on cardiovascular biomarkers in older adults with type 2 diabetes. J Am Coll Cardiol. 2017;70(6):704–12.
-
Trial D-H. Dapagliflozin effects on biomarkers, symptoms, and functional status in patients with heart failure with reduced ejection fraction. Circulation. 2019;140(18):042929.
-
Koh AS, Tay WT, Teng THK, Vedin O, Benson L, Dahlstrom U, Savarese G, Lam CS, Lund LH. A comprehensive population-based characterization of heart failure with mid-range ejection fraction. Eur J Heart Fail. 2017;19(12):1624–34.
-
Tsuji K, Sakata Y, Nochioka K, Miura M, Yamauchi T, Onose T, Abe R, Oikawa T, Kasahara S, Sato M. Characterization of heart failure patients with mid-range left ventricular ejection fraction—a report from the CHART-2 Study. Eur J Heart Fail. 2017;19(10):1258–69.
-
From AM, Scott CG, Chen HH. The development of heart failure in patients with diabetes mellitus and pre-clinical diastolic dysfunction: a population-based study. J Am Coll Cardiol. 2010;55(4):300–5.
-
Mochizuki Y, Tanaka H, Matsumoto K, Sano H, Toki H, Shimoura H, Ooka J, Sawa T, Motoji Y, Ryo K. Clinical features of subclinical left ventricular systolic dysfunction in patients with diabetes mellitus. Cardiovasc Diabetol. 2015;14(1):1–10.
-
Yu Y-W, Zhao X-M, Wang Y-H, Zhou Q, Huang Y, Zhai M, Zhang J. Effect of sodium–glucose cotransporter 2 inhibitors on cardiac structure and function in type 2 diabetes mellitus patients with or without chronic heart failure: a meta-analysis. Cardiovasc Diabetol. 2021;20(1):1–17.
-
Tanaka H, Soga F, Tatsumi K, Mochizuki Y, Sano H, Toki H, Matsumoto K, Shite J, Takaoka H, Doi T. Positive effect of dapagliflozin on left ventricular longitudinal function for type 2 diabetic mellitus patients with chronic heart failure. Cardiovasc Diabetol. 2020;19(1):1–9.
-
Cappetta D, De Angelis A, Ciuffreda LP, Coppini R, Cozzolino A, Miccichè A, Dell’Aversana C, D’Amario D, Cianflone E, Scavone C. Amelioration of diastolic dysfunction by dapagliflozin in a non-diabetic model involves coronary endothelium. Pharmacol Res. 2020;157:104781.
-
Santos-Gallego CG, Requena-Ibanez JA, San Antonio R, Garcia-Ropero A, Ishikawa K, Watanabe S, Picatoste B, Vargas-Delgado AP, Flores-Umanzor EJ, Sanz J. Empagliflozin ameliorates diastolic dysfunction and left ventricular fibrosis/stiffness in nondiabetic heart failure: a multimodality study. JACC Cardiovasc Imaging. 2021;14(2):393–407.
-
Solomon SD, Zile M, Pieske B, Voors A, Shah A, Kraigher-Krainer E, Shi V, Bransford T, Takeuchi M, Gong J, et al. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial. Lancet. 2012;380(9851):1387–95.
-
Velazquez EJ, Morrow DA, DeVore AD, Duffy CI, Ambrosy AP, McCague K, Rocha R, Braunwald E. Angiotensin-neprilysin inhibition in acute decompensated heart failure. N Engl J Med. 2019;380(6):539–48.
-
Januzzi JL Jr. Will biomarkers succeed as a surrogate endpoint in heart failure trials? JACC Heart Fail. 2018;6(7):570–2.
-
Hardwick AB, Ambrosy AP. Natriuretic peptides as a surrogate endpoint in clinical trials—a riddle wrapped in an enigma. Eur J Heart Fail. 2019;21(5):621–3.



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย