本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
最新研究發現,在2型糖尿病患者中,針對正常糖化血紅蛋白水平的強化治療在3.5年內未能顯著減少主要心血管事件,反而增加了死亡風險。研究涵蓋10,251名患者,發現接受強化治療組的死亡率高於標準治療組,且較易發生低血糖和體重增加

2型糖尿病中強化降血糖的效果
Effects of Intensive Glucose Lowering in Type 2 Diabetes
N Engl J Med 2008; 358:2545-2559 DOI: 10.1056/NEJMoa0802743
https://pubmed.ncbi.nlm.nih.gov/18539917/
Abstract
BACKGROUND
Epidemiologic studies have shown a relationship between glycated hemoglobin levels and cardiovascular events in patients with type 2 diabetes. We investigated whether intensive therapy to target normal glycated hemoglobin levels would reduce cardiovascular events in patients with type 2 diabetes who had either established cardiovascular disease or additional cardiovascular risk factors.
METHODS
In this randomized study, 10,251 patients (mean age, 62.2 years) with a median glycated hemoglobin level of 8.1% were assigned to receive intensive therapy (targeting a glycated hemoglobin level below 6.0%) or standard therapy (targeting a level from 7.0 to 7.9%). Of these patients, 38% were women, and 35% had had a previous cardiovascular event. The primary outcome was a composite of nonfatal myocardial infarction, nonfatal stroke, or death from cardiovascular causes. The finding of higher mortality in the intensive-therapy group led to a discontinuation of intensive therapy after a mean of 3.5 years of follow-up.
RESULTS
At 1 year, stable median glycated hemoglobin levels of 6.4% and 7.5% were achieved in the intensive-therapy group and the standard-therapy group, respectively. During follow-up, the primary outcome occurred in 352 patients in the intensive-therapy group, as compared with 371 in the standard-therapy group (hazard ratio, 0.90; 95% confidence interval [CI], 0.78 to 1.04; P=0.16). At the same time, 257 patients in the intensive-therapy group died, as compared with 203 patients in the standard-therapy group (hazard ratio, 1.22; 95% CI, 1.01 to 1.46; P=0.04). Hypoglycemia requiring assistance and weight gain of more than 10 kg were more frequent in the intensive-therapy group (P<0.001).
CONCLUSIONS
As compared with standard therapy, the use of intensive therapy to target normal glycated hemoglobin levels for 3.5 years increased mortality and did not significantly reduce major cardiovascular events. These findings identify a previously unrecognized harm of intensive glucose lowering in high-risk patients with type 2 diabetes. (ClinicalTrials.gov number, NCT00000620
摘要
背景
流行病學研究顯示,2型糖尿病患者的糖化血紅蛋白水平與心血管事件之間存在關係。我們調查了是否將強化治療目標設定在正常糖化血紅蛋白水平以下,能減少已經患有心血管疾病或有額外心血管風險因素的2型糖尿病患者的心血管事件。
方法
在這項隨機研究中,將10,251名患者(平均年齡62.2歲)分為兩組,其中糖化血紅蛋白水平中位數為8.1%。一組接受強化治療(目標糖化血紅蛋白水平低於6.0%),另一組接受標準治療(目標糖化血紅蛋白水平介於7.0至7.9%之間)。其中,38%為女性,35%曾有過心血管事件。主要結果是非致命性心肌梗塞、非致命性中風或心血管原因死亡的綜合結果。在強化治療組中發現較高的死亡率,導致在平均3.5年的隨訪後停止了強化治療。
結果
在1年的時間內,強化治療組和標準治療組分別達到了穩定的中位數糖化血紅蛋白水平,分別為6.4%和7.5%。在隨訪期間,強化治療組中有352名患者發生主要結果,而標準治療組中有371名患者發生主要結果(危險比為0.90;95%信心區間[CI],0.78至1.04;P=0.16)。與此同時,強化治療組中有257名患者死亡,而標準治療組中有203名患者死亡(危險比為1.22;95%CI,1.01至1.46;P=0.04)。需要幫助的低血糖和體重增加超過10公斤在強化治療組中更經常發生(P<0.001)。
結論
與標準治療相比,使用強化治療來達到正常糖化血紅蛋白水平3.5年增加了死亡率,並未顯著減少主要心血管事件。這些發現識別了在2型糖尿病高風險患者中強化降血糖的先前未認識的危害。 (ClinicalTrials.gov編號,NCT00000620.)
2型糖尿病(T2DM)是一種基於持續高血糖診斷的代謝性疾病。患有2型糖尿病的人面臨多種嚴重健康問題的風險,包括心血管疾病、早逝、失明、腎功能衰竭、截肢、骨折、虛弱、抑鬱和認知衰退。在前瞻性流行病學研究中,許多這些結果的發生率與高血糖程度直接相關,這是通過血漿葡萄糖或糖化血紅蛋白水平來測量的,糖化血紅蛋白是前2至3個月內平均血糖水平的一個指標。因此,在調整其他風險因素後,糖化血紅蛋白水平每增加1%,與心血管事件風險增加18%、死亡風險增加12%至14%以及視網膜病變或腎功能衰竭風險增加37% 相關。
糖化血紅蛋白水平與心血管事件和死亡之間的分級關係暗示,降低糖化血紅蛋白水平的治療策略可能會減少這些結果。這一假設得到了一些以前的臨床試驗的結果支持,但並不是所有試驗都支持這一假設。然而,目前仍然缺乏充分證據,明確證明了使用目前可用的治療方法來實現接近正常糖化血紅蛋白和血糖水平的風險和益處。
《控制糖尿病心血管風險行動(ACCORD)試驗》專門設計來確定一種治療策略,即將糖化血紅蛋白水平(即低於6.0%)作為治療目標,是否能夠降低與以心血管疾病或其他心血管風險因素為伴隨的2型糖尿病中年和老年人相比,將糖化血紅蛋白水平設定在7.0至7.9%的速率的心血管事件。在強化治療組中發現較高的死亡率,於2008年2月在研究原定結束日期前17個月決定終止了強化療程。我們報告了對所有患者以及預定子組中的強化干預對死亡率和主要心血管事件的影響。
方法
合格性和研究設計
該試驗的基礎和設計,以及對血糖干預的描述已經先前報告過。簡而言之,這個正在進行中的多中心臨床研究由美國國立心臟,肺部和血液學研究所(NHLBI)資助,在美國和加拿大的77個臨床中心(聚合在七個網絡中)進行。我們招募了患有2型糖尿病並且糖化血紅蛋白水平為7.5%或更高的志願者,他們要么年齡介於40歲和79歲之間並且患有心血管疾病,要么年齡介於55歲和79歲之間並且具有重要動脈粥樣硬化的解剖學證據,白蛋白尿,左心室肥厚,或者至少具有其他兩個心血管疾病風險因素(血脂異常,高血壓,目前吸煙,或肥胖)。9 重要的排除標準包括頻繁或最近的嚴重低血糖事件,不願意進行家庭血糖監測或注射胰島素,體重指數(體重(千克)除以身高(米)的平方)超過45,血清肌酐水平超過1.5毫克/分升(133微摩爾/升),或其他嚴重疾病。
所有10,251名患者都被隨機分配接受全面的強化治療,以降低糖化血紅蛋白水平低於6.0%,或接受標準治療,以達到7.0至7.9%的水平。通過使用雙二乘二設計,有4733名患者被隨機分配接受強化治療(收縮壓目標,<120毫米汞柱)或標準治療(收縮壓目標,<140毫米汞柱)以降低血壓。此外,有5518名患者被隨機分配接受芬布拉特或安慰劑,同時通過西伐他汀(simvastatin)保持低密度脂蛋白膽固醇的良好控制。11 這些血壓和脂質試驗仍在進行中,有關它們的結果仍然被遮蔽。試驗方案已獲得每個中心的機構審查委員會或倫理委員會的批准,以及NHLBI的審查小組的批准。所有患者提供了書面知情同意。
患者收到有關糖尿病護理的教材和行為諮詢,並提供降糖藥物(來自研究監督的配方)和血糖監測用品。任何市場上的降糖治療,如果不在配方中提供,也可以開給任何患者,但不是由研究調查人員提供。治療方案根據調查人員和患者的判斷以及研究組分配和治療反應個性化設定。治療的不良反應在本地和中央都受到仔細的審核,以確保患者的安全。12
強化治療組的患者在前4個月每月參加一次訪問,然後以後每2個月進行一次,至少進行一次臨時電話通話,目的是迅速且安全地將糖化血紅蛋白水平降至6.0%以下。根據以前的描述,如有需要,可以安排額外的訪問以實現血糖目標。9,10 標準治療組的患者每4個月進行一次血糖管理訪問。
主要和次要結果
預定的主要結果是首次發生非致命性心肌梗塞、非致命性中風或心血管原因的死亡。後者包括心肌梗塞死亡、心力衰竭、心律不整、侵入性心血管干預、非心血管手術後的心血管原因、中風、在症狀發作後24小時內被認為是缺血性心血管疾病的突發性死亡,以及其他血管疾病的死亡。9 死於任何原因是預先指定的次要結果之一。研究調查人員還測量了干預對微血管疾病、低血糖、認知和生活質量的影響,儘管這些結果未在此處報告。中央委員會根據預定的標準對關鍵結果進行了裁定。13 一個不知道研究組分配的中央實驗室分析了糖化血紅蛋白水平的血液。協調中心和NHLBI項目辦公室之外的研究調查人員不知道研究結果的累積率。
安全性和有效性分析
由NHLBI任命的獨立的10名數據和安全性監測委員會每約6個月審查一次中期結果。該委員會的角色是監測主要結果和死於任何原因的情況,確保患者的安全,提出繼續或改變研究設計的建議,並在存在明確的益處或危害證據時建議NHLBI。在幾個月的死亡趨勢審查後(作為預先計劃的安全性分析的一部分),在2008年1月8日,該委員會得出結論,即與標準治療組相比,強化療法組死於任何原因的增加死亡率所伴隨的危害超過了任何潛在的益處,建議出於安全原因停止強化療程。這個建議被NHLBI接受。患者於2008年2月5日被告知這一決定,隨後被轉換到標準的糖代謝療法。公眾於2008年2月6日通過新聞發布得知了這一決定。本報告基於截至2007年12月10日提交給協調中心的數據,這些數據被數據和安全監測委員會用來提出建議。一些死亡原因的裁定在該日期之後完成。
統計分析
該研究旨在以89%的功率檢測強化療法組患者的主要結果率較標準療法組降低15%,假設雙尾α水平為0.05,標準療法組主要結果率為每年2.9%,計劃平均隨訪時間約為5.6年。最初的病人數和每個研究組的功率計算是在假設血壓和脂質干預將產生它們設計的效應大小的情況下進行的。所有統計分析均在協調中心使用S-Plus軟件版本8.0(Insightful)或SAS軟件版本9.1(SAS Institute)進行。使用卡方檢驗和雙樣本t檢驗比較了兩個研究組的基線特徵。在每次評估訪問時,使用中位數和四分位距總結了糖化血紅蛋白水平。葡萄糖降低藥物的暴露根據研究組的不同,作為接受藥物處方的患者數和處方的總人年數來總結。使用Fisher的精確檢驗比較了關鍵安全結果的發生率,包括嚴重低血糖、心臟衰竭、病人是駕駛員的機動車事故、液體滯留、氨基轉移酶升高水平和體重增加。
主要和次要結果的分析是根據意圖治療原則使用時間至事件方法進行的,並且使用危險比和95%置信區間比較了這些結果在兩個研究組中的發生。雙尾P值是從Cox比例危險回歸分析的似然比檢驗獲得的。我們對生存估計與隨訪時間的圖形進行檢查,顯示糖化血紅蛋白干預的比例危險的假設似乎是有效的。Cox模型包含代表研究組分配的項目,以及考慮以下預定義分層變量的項目:分配到血壓試驗或脂質試驗,分配到血壓試驗中的強化血壓干預,分配到脂質試驗中的擲丸,七個臨床中心網絡,以及是否有先前的心血管事件。還進行了一項分析,以評估在Cox模型中將這些變量作為分層因子而不是协订因子時結果的敏感性。事件率以每年隨訪百分比的形式表示,考慮到隨訪數據的審查。Kaplan-Meier估計值用於獲取隨訪期間發生事件的患者比例。
我們使用Cox模型內的治療效應和次群體之間的交互作用的統計檢驗來評估對總死亡率和主要結果的研究組分配效應的一致性。我們報告了所有名義P值,未經調整,未考慮與該研究或由數據和安全性監測委員會監測的主要和死亡結果相關的多重性。由於我們進行了15項與次要結局和次群體相關的假設的統計檢驗,假定測試之間獨立,以α水平為0.05,這些測試中至少有一個測試在統計學上是顯著的機會為54%(即1- [1-0.05]15)。
事後探索性分析旨在確定強化療法組中較高死亡率相關因素,考慮了基線特徵、低血糖事件、低血糖事件的風險因素、單一處方的藥物、藥物組合、共同介入、體重變化、達到的血壓、達到的糖化血紅蛋白水平以及隨訪期間的心血管事件。這些和其他潛在的因果因素或機制的詳細分析將另行報告。
结果
患者
共有10,251名男性和女性,平均年齡為62.2±6.8歲,中位糖化血紅素水平為8.1%(四分位距,7.6至8.9),被隨機分配到強化治療組或標準治療組(有關本文的完整 文本可在www.nejm.org上取得,見附錄的圖)。 整個患者群中約有38%為女性。 招募分為兩個階段:2001年1月至6月的20週內招募了1,174名患者,2003年2月至2005年10月招募了9,077名患者。 14表1顯示,兩個研究組的關鍵基線特徵相似。 在資料和安全性監測委員會建議停用強化療法的時候,平均追蹤時間為3.5年(中位數3.4)。
表1患者的基線特徵。

這兩種治療策略迅速實現了不同的糖化血紅素水平(圖1)。 隨機分組後的4個月內,強化治療組的中位糖化血紅素水準從基線的8.1%下降到6.7%(四分位數間距,6.2至7.2),標準治療組為7.5%(四分位數間距, 7.0至8.2)。 在1年內,兩組分別達到了穩定的中位數水平,分別為6.4%(四分位距,6.1至7.0)和7.5%(四分位距,7.0至8.1),並在隨訪期間保持不變 。
圖1每次研究訪問的糖化血紅蛋白水平中位數。
表2處方的降糖藥物。
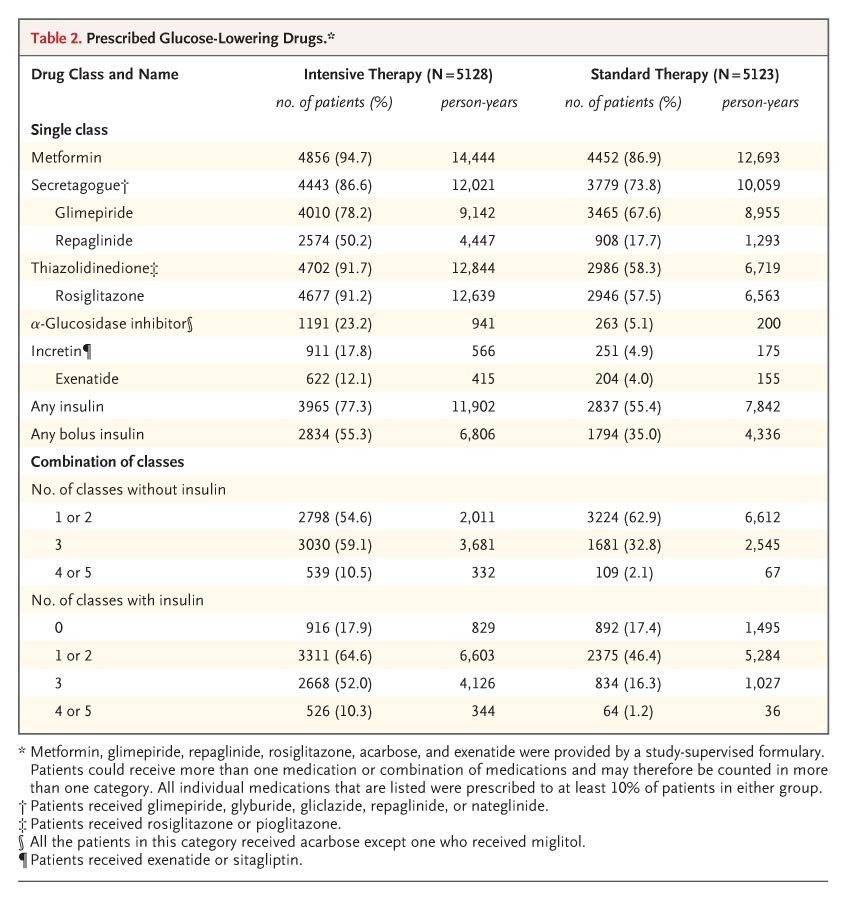
強化治療組中的較低糖化血紅蛋白水平與更多類別的藥物接觸有關(表2)。藥物的劑量或使用的數量也更經常變更。在強化治療組中,降糖方案的修改平均每年進行4.4次,而在標準治療組中則為2.0次,這包括添加或移除藥物,或增加或減少口服藥物或胰島素的劑量(相對於之前的劑量增加或減少≥10%)。
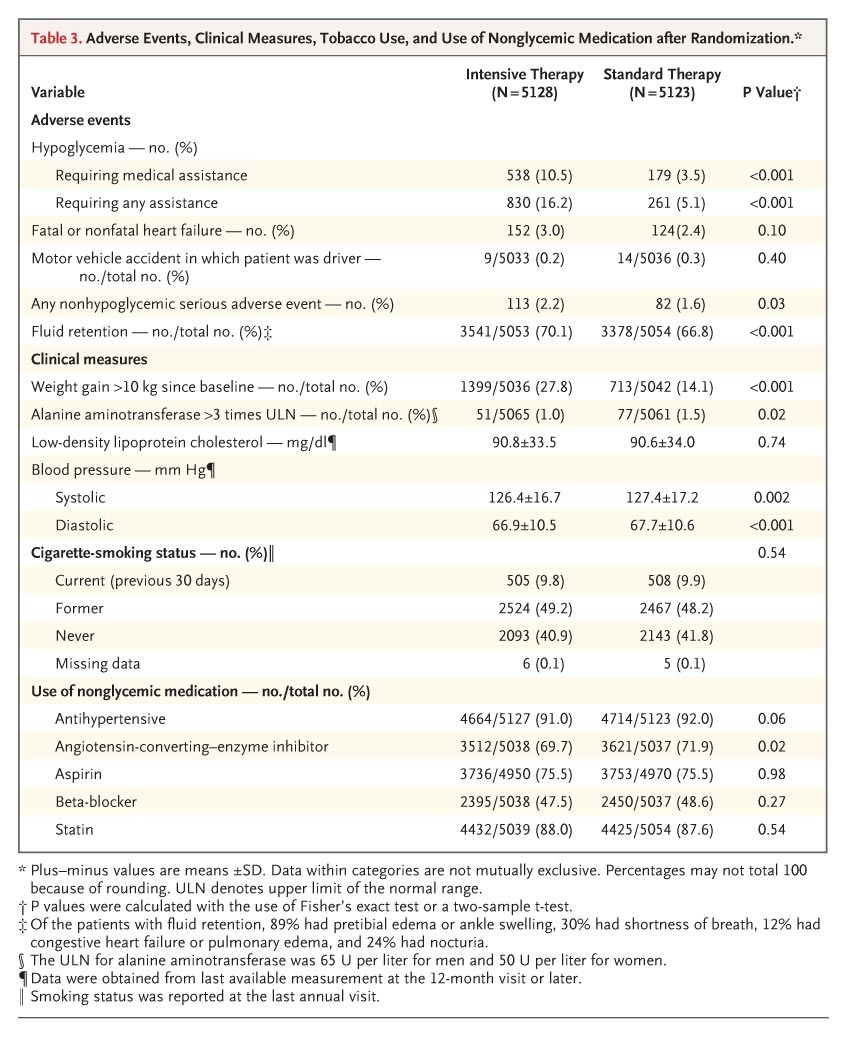
相較於標準治療組,強化治療組出現了明顯較高的低血糖、體重增加和液體滯留率(見表3)。需要醫療援助的低血糖事件的年發生率在強化治療組中為3.1%,標準治療組中為1.0%,而在3年內的平均體重增加分別為3.5公斤和0.4公斤。根據死因審查的分析,每組均有一例死亡被歸類為可能與低血糖有關。兩組患者接受心血管保護措施的暴露類似,並且與心血管事件相關的非糖代謝特徵變化也相似(見表3)。強化治療組中明顯較少的患者接受抑制血管轉換酶(ACE)抑制劑,與標準治療組相比(69.7%比71.9%,P=0.02)。然而,強化治療組的血壓水平略低。
在干預期間,723名患者出現了主要的複合結果,包括非致命性心肌梗塞、非致命性中風或心血管原因的死亡,並且有460例死於任何原因。在由數據和安全監測委員會審查的數據中,前12個月內已確定了97.8%患者的生命狀況;有50名患者(0.5%,包括強化治療組的26名患者和標準治療組的24名患者)失去了隨訪,還有162名患者(1.6%,包括強化治療組的84名患者和標準治療組的78名患者)撤回了同意。對於撤回同意或失去隨訪的患者,平均隨訪時間在強化治療組為1.2年,在標準治療組為1.0年(P=0.22)。強化治療組中複合主要結果的發生次數較少,兩個研究組在3年後開始分開(見表4和圖2A)。這一趨勢不具有統計學意義,強化治療組的發病率為6.9%,標準治療組的為7.2%(危險比為0.90;95%信賴區間[CI],0.78至1.04;P=0.16)。在強化治療組中,非致命性心肌梗塞的發病率低於標準治療組(3.6% vs. 4.6%;危險比為0.76;95% CI,0.62至0.92;P=0.004),而心血管原因的死亡率較高(2.6% vs. 1.8%;危險比為1.35;95% CI,1.04至1.76;P=0.02);在非致命性中風的發病率方面沒有顯著差異(1.3% vs. 1.2%;危險比為1.06;95% CI,0.75至1.50;P=0.74)。
表3隨機分配後的不良事件、臨床測量、煙草使用和非糖代謝藥物使用情況。
主要和次要結果。
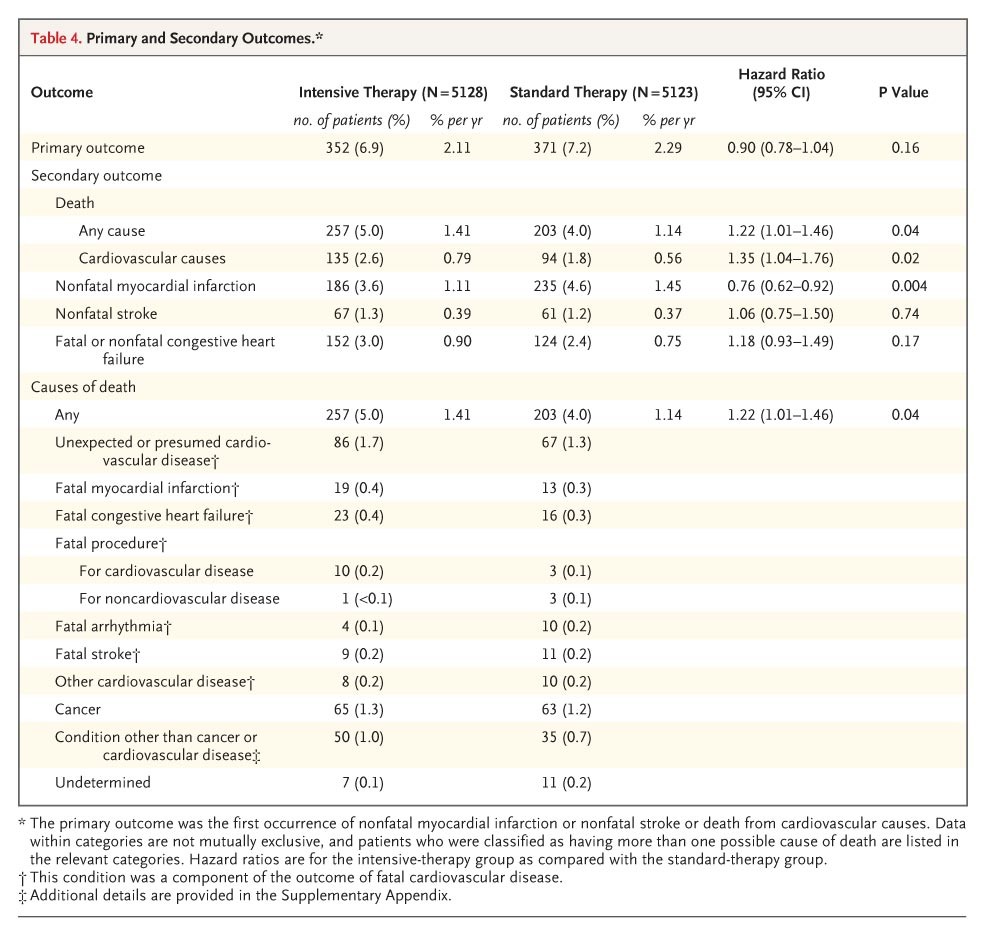
強化治療組任何原因的死亡率高於標準治療組(5.0% vs. 4.0%;危險比為1.22;95%信賴區間,1.01至1.46;P=0.04)。在考慮變數作為分層因素而不是协变量的任何原因死亡的Cox模型的敏感性分析中,相較於標準治療組,強化治療組的死亡風險比估計值穩定至小數點第二位。兩個研究組的死亡率在1年後開始分開,差異在隨訪期間持續存在(見圖2B)。對於亞組內的死亡效應一致,沒有異質性的證據(見圖3),並且在調整了血壓和脂質藥物使用差異的模型中仍然存在。
對於主要結果,有一些預先指定的亞組之間存在異質性的證據,這表明在強化治療組中,那些在隨機分配之前未曾發生心血管事件的患者(互動P值=0.04)或其基線糖化血紅蛋白水平為8.0%或以下的患者(互動P值=0.03)可能比標準治療組中的患者發生更少的致命或非致命心血管事件(見圖3)。隨機分配後的嚴重低血糖事件和藥物使用(包括羅格列酮)、體重變化和其他因素的初步非預定義的探索性分析並未找到解釋死亡結果的原因。
圖2主要結果和任何原因的死亡的Kaplan-Meier曲線。
圖3預先指定的亞組中主要結果和任何原因的死亡的危險比。
討論
我們進行這項研究是因為先前的臨床試驗未能確定對於2型糖尿病患者,強化的降糖治療對心血管事件或死亡的影響。例如,在英國前瞻性糖尿病研究中,一種強化的降糖治療方案相對於傳統治療明顯減少了七個與糖尿病相關的事件的綜合結果。但是,對心血管事件和死亡的影響並不明顯。相反,在退伍軍人事務部糖尿病可行性試驗中,強化的降糖治療與心血管事件的增加(雖然不具統計學意義)以及死亡率的無差異相關,而在大學團體糖尿病計劃中,接受磺酰脲(托布特胺)的患者的死亡率更高。
我們的研究結果表明,針對糖化血紅蛋白水平低於6.0%的全面、定制的治療策略,與針對糖化血紅蛋白水平為7.0%至7.9%的策略相比,在具有中位數糖化血紅蛋白水平為8.1%以及既有心血管事件史或多重心血管風險因素的患者中,導致了任何原因的死亡率在平均3.5年後增加。兩組患者的死亡率都低於類似患者的流行病學研究所報告的死亡率。然而,與標準治療組相比,強化治療組的死亡率相對增加了22%,在此隨訪期間絕對增加了1.0%,並且心血管原因的死亡差異相似。這種死亡率增加相當於每95名接受治療3.5年的患者中有一名額外的死亡。
本研究並非旨在測試干預策略的各個組成部分。到目前為止,我們進行的分析未能找到導致死亡率上升的明確解釋。在強化治療組中,通過行為和藥物的組合方法,迅速達到了並維持了6.4%的糖化血紅蛋白中位數水平。標準治療組進行的研究訪問較少,使用的藥物和藥物組合也較少。因此,強化治療組中死亡率較高可能與與各種策略相關的因素有關。這些因素包括但不限於強化治療組中實現的6.4%的糖化血紅蛋白水平,與標準治療組的7.5%相比;在兩個研究組中糖化血紅蛋白水平下降的幅度;在隨機分配後的前4個月內糖化血紅蛋白水平下降的速度,強化治療組約為1.4%,標準治療組約為0.6%;在藥物方案的變化以及低血糖的發生率方面;在由於各種高劑量藥物的交互作用而導致的不良影響;或者是這些因素的某種組合,或許還包括患者的臨床特徵等許多其他可能性。
死亡率的差異在隨機分配後的1年至2年內逐漸浮現。值得注意的是,大約在3年後,強化治療組的主要結果率出現了不具統計學意義的下降(見圖2A),這是由於非致命性心肌梗塞明顯減少,儘管心血管原因的死亡更多,中風的數量相似(見表4)。就死亡率和主要結果而言,這些模式表明,如果強化的降糖治療有任何益處,可能需要幾年的時間才能浮現,在此期間死亡風險增加。只有進一步的研究才能回答這個引人入勝的可能性。
我們研究的優勢包括患者隨機分配到研究組,根據共同協議對大量高風險患者進行隨訪,高隨訪率,實現和維持3.5年的糖化血紅蛋白水平的絕對差異為1.1%,在常規診所實施,這些診所通常治療社區患者,由一個不知道研究組分配的委員會對結果進行裁決,一個因子設計,其中血壓和脂質干預仍在測試中,以及由一個獨立委員會進行的安全審核。然而,我們的研究未能探討降低糖化血紅蛋白水平的不同方法(包括何種速率的降糖最佳)、預防2型糖尿病患者糖化血紅蛋白水平低於7.5%的增加、完全預防糖尿病以及降低糖化血紅蛋白水平但沒有心血管疾病或其他心血管風險因素的人群。事實上,對於糖化血紅蛋白水平較低或沒有心血管疾病的患者在主要結果方面提出更多好處的建議,這引發了某些患者亞組可能受益於強化降糖治療的可能性。但是,我們的研究並未旨在測試這些可能性。最後,降糖策略是根據每位患者的研究組分配、對藥物或藥物組合的後續血糖反應以及臨床症狀(如低血糖)以公開方式進行調整的。這種將研究組分配與隨機分配後的曝露相聯接,意味著分析以辨識或排除導致觀察到的結果的治療策略的哪些方面對其產生貢獻,可能不太可能清晰地確定或排除原因。因此,對於強化治療組中死亡率增加的可能原因的非預定義分析只能是探索性的,需要進行前瞻性測試。
對於那些從強化治療轉換到標準治療的患者進行長期隨訪,可能提供了關於在強化治療3.5年後的長期死亡率和心血管事件率的重要信息。其他調查強化降糖治療長期結果的試驗將報告針對2型糖尿病患者和一系列臨床特徵的患者,在死亡率和心血管事件方面對各種治療方法的影響。無論其他試驗的結果如何,我們的研究已經確定了在2型糖尿病高風險患者和高糖化血紅蛋白水平中進行強化降糖治療的未曾認識到的危害。這種危害可能是由於迅速降低糖化血紅蛋白水平的方法或達到的水平所致。我們的發現強調了進行具有足夠統計功效的試驗以評估常用方法對臨床相關結果的重要性。
本研究獲得以下資助:美國國家心臟、肺部和血液研究所的資助(N01-HC-95178、N01-HC-95179、N01-HC-95180、N01-HC-95181、N01-HC-95182、N01-HC-95183、N01-HC-95184、IAA-Y1-HC-9035和IAA-Y1-HC-1010);其他美國國立衛生研究院的部門,包括美國國立糖尿病和消化性腎疾病研究所、美國國立老年研究所和美國國立眼科研究所的資助;美國疾病控制和預防中心的資助;以及一般臨床研究中心的資助。以下公司提供了研究藥物、設備或用品:Abbott Laboratories、Amylin Pharmaceutical、AstraZeneca、Bayer HealthCare、Closer Healthcare、GlaxoSmithKline、King Pharmaceuticals、Merck、Novartis、Novo Nordisk、Omron Healthcare、Sanofi-Aventis和Schering-Plough。
Gerstein博士報告收到了來自Sanofi-Aventis、GlaxoSmithKline、Merck、Abbott、Novo Nordisk、Novartis和Lilly的咨詢費,來自Sanofi-Aventis、GlaxoSmithKline、Merck和Lilly的講座費,以及來自Sanofi-Aventis、GlaxoSmithKline、King和Merck的資助,並擁有一項完全歸Sanofi-Aventis所有的專利,並且不收取版稅或利益;Goff博士報告收到了Merck的資助;Bigger博士報告收到了麥克馬斯特大學的資助;Buse博士擁有Insulet、MicroIslet和dLife的股權,並收到了來自Bristol-Myers Squibb、Novartis、Pfizer、Novo Nordisk、Amylin、Eli Lilly和Medtronic的資助;Cushman博士報告收到了來自Novartis、King、Takeda和Sanofi-Aventis的咨詢費,來自Novartis的講座費,以及來自Novartis、Hamilton Health和Abbott的資助;Genuth博士報告收到了來自Merck、Mannkind、Sanofi-Aventis和Novartis的咨詢費,來自Lilly的講座費,並擁有Bristol-Myers Squibb的股權;Grimm博士報告收到了Merck、Pfizer和Novartis的講座費;Probstfield博士報告收到了King的咨詢費和來自King和Sanofi-Aventis的資助。本文發表於2008年6月6日的www.nejm.org(DOI:10.1056/NEJMoa0802743)。
參考文獻
-
Goff DC Jr, Gerstein HC, Ginsberg HN, et al. Prevention of cardiovascular disease in persons with type 2 diabetes mellitus: current knowledge and rationale for the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial. Am J Cardiol 2007;99:4i–20i
-
2.Selvin E, Marinopoulos S, Berkenblit G, et al. Meta-analysis: glycosylated hemoglobin and cardiovascular disease in diabetes mellitus. Ann Intern Med 2004;141:421–431
-
3.Gerstein HC, Pogue J, Mann JF, et al. The relationship between dysglycaemia and cardiovascular and renal risk in diabetic and non-diabetic participants in the HOPE study: a prospective epidemiological analysis. Diabetologia 2005;48:1749–1755
-
4.Stratton IM, Adler AI, Neil HA, et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 2000;321:405–412
-
5.American Diabetes Association. Standards of medical care in diabetes — 2008. Diabetes Care 2008;31:Suppl 1:S12–S54
-
6.Canadian Diabetes Association Clinical Practice Guidelines Expert Committee. Canadian Diabetes Association 2003 clinical practice guidelines for the prevention and management of diabetes in Canada. Can J Diabetes 2003;23:Suppl 2:S1–S152
-
7.Ryden L, Standl E, Bartnik M, et al. Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary. Eur Heart J 2007;28:88–136
-
8.AACE Diabetes Mellitus Clinical Practice Guidelines Task Force. American Association of Clinical Endocrinologists medical guidelines for clinical practice for the management of diabetes mellitus. Endocr Pract 2007;13:Suppl 1:1–68
-
9.Buse JB, Bigger JT, Byington RP, et al. Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial: design and methods. Am J Cardiol 2007;99:21i–33i
-
10.Gerstein HC, Riddle MC, Kendall DM, et al. Glycemia treatment strategies in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial. Am J Cardiol 2007;99:34i–43i
-
11.Ginsberg HN, Bonds DE, Lovato LC, et al. Evolution of the lipid trial protocol of the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial. Am J Cardiol 2007;99:56i–67i
-
12.Bonds DE, Kurashige EM, Bergenstal R, et al. Severe hypoglycemia monitoring and risk management procedures in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial. Am J Cardiol 2007;99:80i–89i
-
13.ACCORD Web site. (Accessed May 19, 2008, at http://www.accordtrial.org. opens in new tab.)
-
14.Kingry C, Bastien A, Booth G, et al. Recruitment strategies in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial. Am J Cardiol 2007;99:68i–79i
-
15.UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998;352:837–853[Erratum, Lancet 1999;354:602.]
-
16.Abraira C, Colwell JA, Nuttall F, et al. Cardiovascular events and correlates in the Veterans Affairs Diabetes Feasibility Trial: Veterans Affairs Cooperative Study on Glycemic Control and Complications in Type II Diabetes. Arch Intern Med 1997;157:181–188
-
17.Meinert CL, Knatterud GL, Prout TE, Klimt CR. A study of the effects of hypoglycemic agents on vascular complications in patients with adult-onset diabetes. II. Mortality results. Diabetes 1970;19:Suppl:789–830
-
18.Genuth S. Exogenous insulin administration and cardiovascular risk in non-insulin-dependent and insulin-dependent diabetes mellitus. Ann Intern Med 1996;124:104–109
-
19.Booth GL, Kapral MK, Fung K, Tu JV. Relation between age and cardiovascular disease in men and women with diabetes compared with non-diabetic people: a population-based retrospective cohort study. Lancet 2006;368:29–36
-
20.Thomas RJ, Palumbo PJ, Melton LJ III, et al. Trends in the mortality burden associated with diabetes mellitus: a population-based study in Rochester, Minn, 1970-1994. Arch Intern Med 2003;163:445–451
-
21.Abraira C, Duckworth W, McCarren M, et al. Design of the cooperative study on glycemic control and complications in diabetes mellitus type 2: Veterans Affairs Diabetes Trial. J Diabetes Complications 2003;17:314–322
-
22.Study rationale and design of ADVANCE: action in diabetes and vascular disease — preterax and diamicron MR controlled evaluation. Diabetologia 2001;44:1118–1120
-
23.Milicevic Z, Raz I, Strojek K, et al. Hyperglycemia and its effect after acute myocardial infarction on cardiovascular outcomes in patients with Type 2 diabetes mellitus (HEART2D) Study design. J Diabetes Complications 2005;19:80–87
-
24.ORIGIN Trial Investigators, Gerstein H, Yusuf S, Riddle MC, Ryden L, Bosch J. Rationale, design, and baseline characteristics for a large international trial of cardiovascular disease prevention in people with dysglycemia: the ORIGIN Trial (Outcome Reduction with an Initial Glargine Intervention). Am Heart J 2008;155:26–32
-
25.Magee MF, Isley WL. Rationale, design, and methods for glycemic control in the Bypass Angioplasty Revascularization Investigation 2 Diabetes (BARI 2D) Trial. Am J Cardiol 2006;97:20G–30G



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย