本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
研究顯示,中國中老年群體中晚睡、打鼾及超過30分鐘的白日小睡與代謝功能障礙相關脂肪肝病(MAFLD)風險顯著相關。這項橫斷面研究分析了5011名參與者的睡眠行為與MAFLD的關聯,指出健康睡眠分數的提升與降低MAFLD風險相關,尤其在擁有久坐生活方式和中央性肥胖的人群中,睡眠質量差的影響更為顯著。

中年和老年中國人的睡眠因素與代謝功能失調相關脂肪肝疾病的關係
Sleep Factors in Relation to Metabolic Dysfunction-Associated Fatty Liver Disease in Middle-Aged and Elderly Chinese
Jialu Yang, Shiyun Luo, Rui Li, Jingmeng Ju, Zhuoyu Zhang, Jichuan Shen, Minying Sun, Jiahua Fan, Min Xia, Wei Zhu, Yan Liu, Sleep Factors in Relation to Metabolic Dysfunction-Associated Fatty Liver Disease in Middle-Aged and Elderly Chinese, The Journal of Clinical Endocrinology & Metabolism, Volume 107, Issue 10, October 2022, Pages 2874–2882
https://pubmed.ncbi.nlm.nih.gov/35900115/
Abstract
Context
Accumulating evidence implies that sleep disturbance is involved in metabolic disorders.
Objective
We comprehensively evaluated the association between various dimensions of sleep behaviors and the risk for metabolic dysfunction–associated fatty liver disease (MAFLD).
Methods
In this cross-sectional study of 5011 participants with self-reported sleep behaviors and radiologically diagnosed MAFLD, a comprehensive healthy sleep score was generated to evaluate the associations between sleep behaviors and MAFLD risk using multivariate logistic regression adjusting for demographics, lifestyles, medication, and metabolic comorbidities. Furthermore, mediation analysis was utilized to assess the extent to which obesity explains the effect of sleep quality on MAFLD risk.
Results
Late bedtime, snoring, and daytime napping for over 30 minutes significantly associated with an increased risk of MAFLD, with odds ratios (OR) of 1.37 (95% CI 1.10, 1.70), 1.59 (95% CI 1.33, 1.91), and 1.17 (95% CI 1.02, 1.35), respectively, after full adjustments including obesity. Participants with disturbance in nighttime sleep and prolonged daytime napping showed the highest risk for MAFLD (OR 2.38, 95% CI 1.73, 3.27). Each additional increase of healthy sleep score was associated with a 16% reduction in MAFLD risk. Further stratified analysis revealed that people with a sedentary lifestyle and central obesity experienced more prominent adverse effects from poor sleep quality than others. Moreover, obesity accounted for only 20.77% of the total effect of sleep quality on MAFLD risk.
Conclusions
Sleep behaviors, both cumulatively and individually, are associated with MAFLD risk. Public health awareness and strategies should be encouraged to curb MAFLD.
sleep behaviors, daytime napping, metabolic dysfunction–associated fatty liver disease
摘要
背景
積累的證據暗示著睡眠紊亂與代謝異常有關。
目的
我們全面評估了各種維度的睡眠行為與代謝功能失調相關脂肪肝疾病(MAFLD)風險之間的聯繫。
方法
在這項包括5011名參與者的橫斷面研究中,參與者自報睡眠行為並經放射學診斷確認MAFLD,生成了一個全面的健康睡眠得分,使用多變量邏輯回歸進行調整,包括人口統計學、生活方式、藥物和代謝共病,以評估睡眠行為和MAFLD風險之間的關聯。此外,利用中介分析來評估肥胖程度對睡眠質量對MAFLD風險的影響程度。
結果
深夜上床睡覺、打鼾和白天午休超過30分鐘明顯與MAFLD風險增加相關,調整後包括肥胖在內的奧斯比比率(OR)分別為1.37(95%信賴區間1.10,1.70)、1.59(95%信賴區間1.33,1.91)和1.17(95%信賴區間1.02,1.35)。夜間睡眠干擾和白天長時間午休的參與者顯示出最高的MAFLD風險(OR 2.38,95%信賴區間1.73,3.27)。每增加一個健康睡眠分數,與MAFLD風險降低16%相關。進一步的分層分析顯示,久坐生活方式和中心性肥胖的人比其他人更容易受到睡眠質量不佳的不利影響。此外,肥胖僅占睡眠質量對MAFLD風險的總影響的20.77%。
結論
無論是累積還是個別的睡眠行為都與MAFLD風險相關。應鼓勵公共衛生意識和策略以遏制MAFLD。
睡眠行為,白天午休,代謝功能失調相關脂肪肝疾病
正如國際共識最近提出的,代謝功能失調相關脂肪肝疾病(MAFLD)是全球領先的慢性肝病,影響約四分之一的成年人口(1)。作為全身代謝異常的肝臟表現,MAFLD可能進展為末期肝疾病,並增加外肝併發症的風險,對所有社會構成了重大的健康和經濟負擔(2)。
由於不健康生活方式的迅速崛起,過去十年中,中國MAFLD的患病率從18%上升至29%,增幅超出預期(3)。在所有不健康的生活方式中,睡眠紊亂在當代社會變得越來越普遍,也是多種代謝異常的新興因素。例如,已報告短時間的睡眠(4)與非酒精性脂肪肝疾病(NAFLD)風險增加有關。此外,失眠症狀和習慣性打鼾與代謝異常呈正相關,包括高血壓(5, 6)、糖代謝異常(7, 8)和脂質異常(6, 9)。值得注意的是,這些睡眠行為通常相互關聯,可能以協同的方式影響代謝平衡;然而,現有的證據僅限於個別的睡眠行為(4-10),未考慮社區居民各種睡眠行為的複雜性和相互關聯。此外,現有的研究主要關注夜間睡眠行為,很少有研究評估了在中國是獨特習慣但在西方社會不太常見的日間午休對MAFLD風險的影響(11)。關於日間午休對代謝的影響的現有結果部分相互矛盾。一項在法國人中進行的隨機對照試驗報告稱,日間午休可以扭轉由睡眠限制引起的唾液中白介素-6和尿中去甲腎上腺素的變化(12),而其他研究報告了日間午休與肥胖(13)、糖尿病和代謝綜合症(14)之間的正相關。最近,越來越多的證據已經證明了睡眠障礙對肥胖的發病具有因果作用(15),這增加了MAFLD的發展風險(1)。然而,睡眠質量是否構成MAFLD獨立的風險,超越對肥胖的影響仍然不明朗,從而阻礙了針對MAFLD沉重負擔的全面系統性努力。
在這項研究中,我們旨在評估睡眠質量,由健康睡眠分數表徵的主要夜間睡眠行為和日間午休的組合,與華南居民發展MAFLD風險之間的關聯,並進一步評估肥胖對MAFLD風險的潛在中介效應。
材料和方法
研究設計和參與者
數據來自廣東省東莞市南中國總人口(SCC)研究的基線調查。SCC研究是在中國南部4個地理上明確的地區進行的一項基於社區的前瞻性縱向研究。有關SCC和招募的更多詳情在附加方法中提供(16)。在2018年3月至2019年10月之間,招募了5430名年齡在30至79歲之間且無嚴重殘疾的永久居民,進行了基線調查並接受了肝超聲檢查。該研究獲得了中山大學公共衛生學院倫理委員會的批准(L2017-001),並遵守赫爾辛基宣言的原則。從所有參與者獲得了書面知情同意書。
對於本次分析,有419名受試者被排除在外,原因如下:(1)診斷MAFLD的數據不足(n = 41);(2)有肝硬化、肝切除或肝癌的病史(n = 4);(3)腰圍和身體質量指數(BMI)的極端異常值,定義為高於3倍標準差(n = 8);和(4)睡眠行為相關變數的遺漏值(n = 366)[附加圖1(16)]。
MAFLD的定義和評估
MAFLD的診斷是基於肝臟脂肪堆積的超聲檢查和以下三個標準之一的存在:超重/肥胖(BMI≥23 kg/m2)、糖尿病的存在,或代謝失調的證據(17)。代謝失調的定義是至少具有以下2種情況之一:(1)腰圍男性≥90 cm,女性≥80 cm,(2)收縮壓≥130/85 mmHg或正在接受降壓藥物治療,(3)血漿三酸甘油脂≥1.70 mmol/L或正在接受特定藥物治療,(4)男性血漿高密度脂蛋白膽固醇<1.0 mmol/L,女性<1.3 mmol/L或正在接受特定藥物治療,(5)血糖前期,即空腹血糖5.6至6.9 mmol/L,2小時後負荷血糖7.8至11.0 mmol/L,或血紅蛋白A1c 5.7%至6.4%(17)。
腹部超聲掃描是由經驗豐富的超聲波技師執行的,他們不知道研究目的,並對實驗室數值一無所知。圖像是根據受試者處於仰臥姿勢,右臂高舉過頭的標準方式捕獲的(18)。超聲診斷脂肪肝是指肝實質中的細微回聲與腎臟或脾臟實質相比有明顯增加(19)。有關腹部超聲診斷肝臟脂肪堆積的內部和內部變異性的詳細信息在附加方法中提供(16)。
睡眠行為的評估
睡眠行為是使用匹茲堡睡眠質量指數問卷(20)自報的[附加表1(16)]。就寢時間分為3組:晚上10點之前,晚上10點到11點之間,晚上11點之後。夜間睡眠時間分為短期(<7小時/天)、正常(7-8小時/天)和長期(>8小時/天)。失眠、打鼾和白天過度嗜睡是根據回答從不/很少(每週不到一次)、有時(每週一兩次)或通常(每週≥3次)編碼的。白天打盹被分為每天0到30分鐘和>30分鐘兩組。
健康睡眠分數和睡眠質量的定義
低風險睡眠因素被定義為早睡(晚上10點之前或晚上10點到11點之間)、夜間睡眠7到8小時/天、從不/很少失眠、從不/很少打鼾、不常發生白天過度嗜睡和白天打盹≤30分鐘。如果參與者被分為每個睡眠因素的低風險,則他們將獲得1分,否則獲得0分(20)。
夜間睡眠模式,包括就寢時間、夜間睡眠時間、失眠、打鼾和白天過度嗜睡,被定義為健康(夜間睡眠分數=5)、中等(3≤夜間睡眠分數≤4)和差(夜間睡眠分數≤2),總分為5(20)。此外,我們結合了5個夜間睡眠因素和白天打盹,生成了總體健康睡眠分數。然後,將所有6個組件分數相加,以獲得範圍從0到6的健康睡眠分數,較高的分數表示睡眠質量較好。然後,從受限制的立方樣條分析中定義了整體睡眠分數為好(健康睡眠分數≥5)、中等(3≤健康睡眠分數≤4)和差(健康睡眠分數≤2)。
在敏感性分析中,我們通過使用方程式生成了加權睡眠分數:加權睡眠分數=(β1×因子1+β2×因子2+…+β6×因子6)×(6/β係數總和)。加權睡眠分數也範圍從0到6,但考慮了每個睡眠因素的調整相對風險的大小(20)。
其他變數的評估
通過問卷收集了人口特徵、臨床病史、藥物使用、生活方式(包括飲酒、吸煙)以及自報的膳食和身體活動信息。體格檢查和實驗室測量由訓練有素的人員執行。更多細節請參閱附加方法(16)。
統計分析
根據MAFLD的存在,將研究參與者的基本特徵總結為連續變數的平均值(標準差)或中位數(四分位數範圍),以及分類變數的n(%)。為了比較基本特徵,對於正態分佈的變數,使用獨立學生t檢驗,對於高度偏斜分佈的變數,使用曼·惠特尼U檢驗,對於分類變數,使用χ2檢驗。
使用Logistic迴歸估計睡眠行為與MAFLD風險之間的奧德比比率(OR)和95%的信心區間(CI)。多變量Logistic迴歸分析進行了年齡、性別、飲酒、吸煙、久坐時間、飲食多樣性、是否單身、高等教育(是或否)、藥物使用(是或否)、高血壓(是或否)、糖尿病(是或否)以及肥胖(是或否)的調整。透過在完全調整的Logistic迴歸模型中引入2路乘法項來進行交互作用分析。由於夜間睡眠模式和白天打盹之間存在顯著的交互作用(P<0.001),我們通過健康睡眠分數對發展MAFLD風險的聯合影響進行了探索。為了評估MAFLD風險的潛在非線性關係,在完全調整的情況下使用了受限立方樣條,其中在健康睡眠分數的第5、50和95百分位數處有3個結。
為了進一步檢驗我們的結果的穩健性,我們還進行了多個敏感性分析,包括(1)構建加權睡眠分數以評估睡眠行為與MAFLD風險之間的關聯性;(2)亞組分析進一步根據性別、年齡、久坐時間、中心性肥胖、糖尿病和高血壓進行分層,以檢查容易受到與睡眠相關的MAFLD風險的亞族群;(3)排除那些可能影響睡眠行為的藥物的參與者(n = 112)。此外,為了量化睡眠行為與MAFLD風險之間的關聯性有多少是由BMI介導的,我們通過中介分析執行了1000次模擬。
所有數據分析均使用R版本4.0.5(統計計算的R基金會,維也納,奧地利)或SPSS版本25(IBM,Armonk,NY,USA)進行,雙側P<0.05被認為具有統計學意義。
結果
根據MAFLD表型的基線特徵
根據表1中的MAFLD的存在,展示了研究人口的基線特徵。與沒有MAFLD的參與者相比,MAFLD的參與者年齡較大,更可能是女性,受教育程度較高,具有更高的既往代謝性疾病的患病率,代謝狀況較差,但吸煙的患病率較低,久坐時間較少。值得注意的是,MAFLD的參與者中睡眠障礙的患病率,包括較短或較長的夜間睡眠時間、失眠、打鼾和延長的白天打盹,顯著較高。
表1. 根據MAFLD存在與否的研究參與者的基本特徵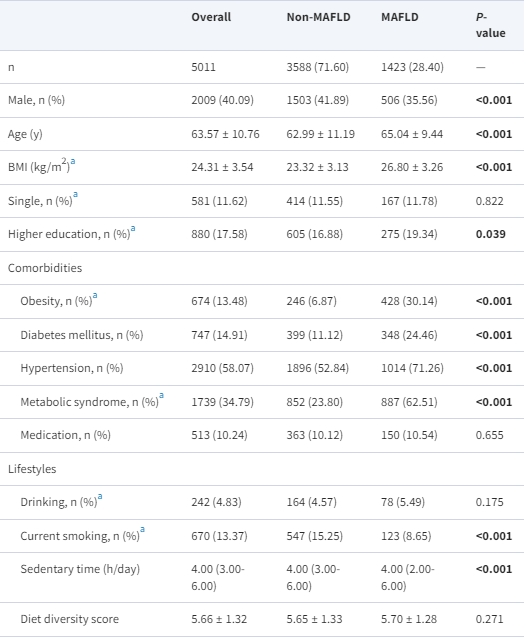
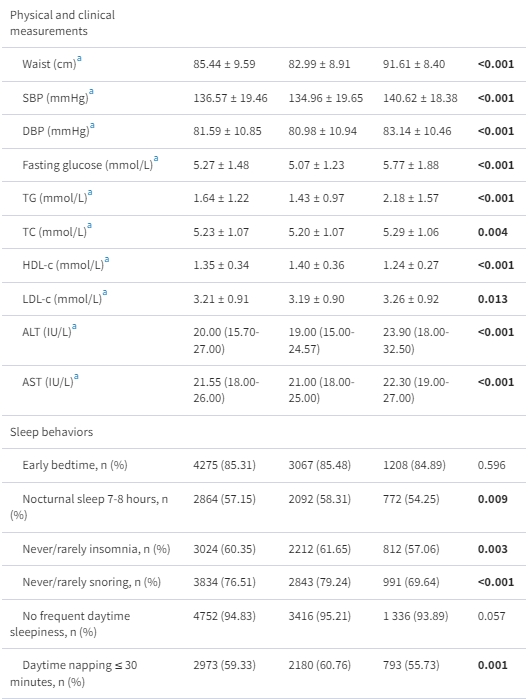
資料以n(%)、平均(SD)或中位數(四分位數)呈現,視情況而定。非MAFLD和MAFLD之間的差異是通過t檢驗或Mann-Whitney U檢驗(連續變數)以及卡方檢驗(分類變數)來檢驗的。
縮寫:ALT,丙氨酸氨基轉移酶;AST,天冬氨酸氨基轉移酶;BMI,身體質量指數;DBP,舒張壓;HDL-c,高密度脂蛋白膽固醇;LDL-c,低密度脂蛋白膽固醇;MAFLD,代謝功能失調相關脂肪肝病;SBP,收縮壓;TC,總膽固醇;TG,三酸甘油脂。
a這些變數有缺失值。具有缺失值的參與者數如下:BMI(n = 11),單身(n = 9),高等教育(n = 5),肥胖(n = 11),代謝綜合徵(n = 12),飲酒(n = 3),目前吸煙(n = 1),腰圍(n = 12),SBP(n = 24),DBP(n = 24),空腹血糖(n = 37),TG(n = 46),TC(n = 46),HDL-c(n = 46),LDL-c(n = 46),ALT(n = 46)和AST(n = 46)。
每個睡眠因素與MAFLD風險之間的關聯
每個睡眠因素與MAFLD風險之間的關聯顯示在表2中。與先前的報告(4、18、21)相反,短時間或長時間的睡眠並未發現與MAFLD風險之間存在關聯。晚上上床睡覺時間過晚【OR 1.37(95% CI 1.10,1.70)】、打鼾【OR 1.59(95% CI 1.33,1.91)】以及白天小睡超過30分鐘【OR 1.17(95% CI 1.02,1.35)】在完全調整後(包括人口統計學、生活方式、藥物治療以及高血壓、糖尿病和肥胖等既往代謝共病)明顯提高了MAFLD風險。在所有這些睡眠行為中,打鼾表現出最強的影響,即使偶爾打鼾也會大幅增加48%的MAFLD風險【OR 1.48(95% CI 1.16,1.87)】。
表2. 經多變量調整後的睡眠因素與代謝功能失調相關脂肪肝疾病的勝算比(95%信賴區間)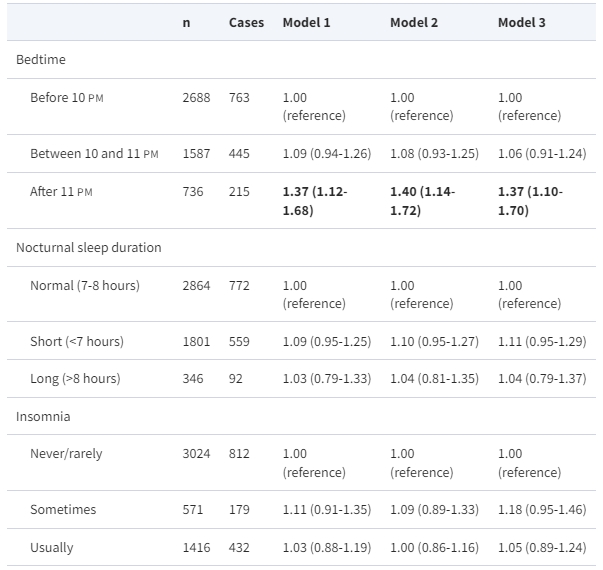
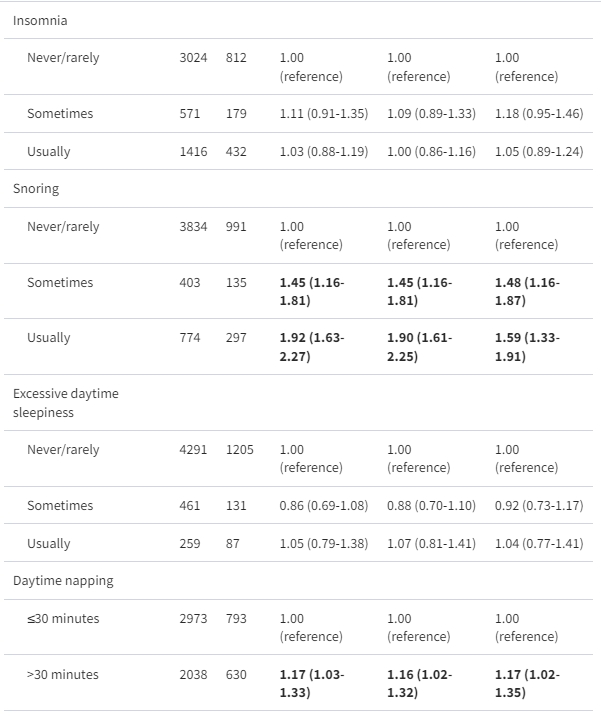
在這個分析中,我們使用多變量調整的 logistic 迴歸模型。所有睡眠行為的維度(上床時間、夜間睡眠持續時間、失眠、打鼾、白天過度嗜睡和白天小睡)同時包括在同一模型中。模型 1:調整年齡和性別;模型 2:模型 1 加上調整飲酒、吸煙、久坐時間、飲食多樣性、是否獨身(是或否)和是否受過高等教育(是或否);模型 3:模型 2 加上調整藥物治療(是或否)、高血壓(是或否)、糖尿病(是或否)和肥胖(是或否)。
當睡眠因素被合併為低風險對高風險的二元類別(參考組)時,早上上床、不打鼾和簡短的白天小睡分別與發展 MAFLD 的風險降低了 24%、35% 和 15%,分別(請參見表 3)。值得注意的是,擁有所有 6 個低風險睡眠因素的參與者在全面調整後 MAFLD 的風險降低了 36% [OR 0.64(95% CI 0.53,0.78)]。
表3. 低風險睡眠因素調整後的多變量奧德斯比比率(95%置信區間),用於代謝功能失調相關的脂肪肝疾病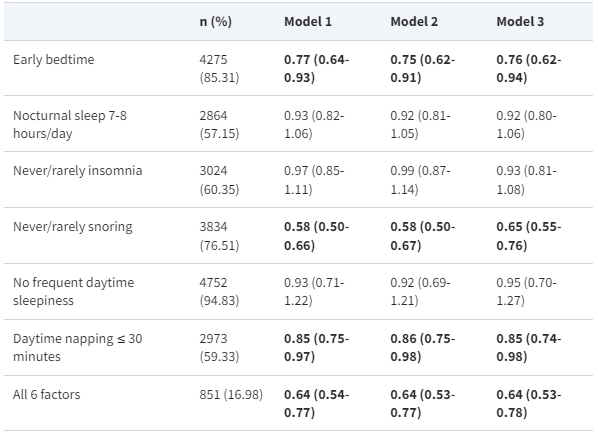
在這個分析中,使用了多變量調整的 logistic 回歸。在評估每個睡眠因素的影響時,同時在同一模型中包括了所有6個低風險的睡眠因素。模型1:調整了年齡和性別;模型2:模型1加上了對飲酒、吸煙、久坐時間、飲食多樣性、是否單身以及是否高教育程度的調整(是或否);模型3:模型2加上了藥物治療(是或否)、高血壓(是或否)、糖尿病(是或否)和肥胖(是或否)的調整。
夜間睡眠模式和日間小睡對MAFLD風險的聯合影響
當一同考慮床上時間、夜間睡眠時間、失眠、打鼾和白天過多的睡意作為夜間睡眠模式時,我們發現夜間睡眠模式和白天小睡之間存在顯著的相互作用(P <0.001)[附錄表2]。與傳統觀念相反,短時間小睡不僅未能彌補由於不良夜間睡眠模式對MAFLD風險的不良影響,還進一步增加了中等和差的夜間睡眠模式對MAFLD風險的影響[圖1;附錄表2]。與那些夜間睡眠模式健康且白天小睡時間不超過30分鐘的人相比,夜間睡眠模式不佳且白天小睡時間過長的受試者患MAFLD的風險顯著增加[OR 2.38 (95% CI 1.73, 3.27)]。
圖1夜間睡眠模式和日間小睡對於代謝異常相關性脂肪肝疾病風險的聯合影響。多變量模型進行了調整,包括年齡、性別、飲酒、吸煙、久坐時間、飲食多樣性、是否單身、是否高教育程度、用藥情況、高血壓(是或否)、糖尿病(是或否)和肥胖(是或否)。參考組包括夜間健康睡眠模式和≤30分鐘日間小睡的參與者。縮寫:MAFLD,代謝相關脂肪肝疾病;OR,勝算比。
睡眠質量與MAFLD風險的相關性
考慮到白天小睡在中國日常生活中的普及以及其在MAFLD中的潛在作用,我們進一步通過整合夜間睡眠行為和白天小睡來建立一個健康的睡眠得分。健康的睡眠得分的增加與MAFLD風險呈現線性下降的顯著性相關(圖2)。每增加一個健康的睡眠得分,MAFLD風險就會減少16%(完全調整的OR 0.84,95% CI 0.80, 0.89)[附錄表3]。與睡眠質量差的人相比,完全調整的中等和良好睡眠質量的人的OR分別為0.71(95% CI 0.55, 0.91)和0.55(95% CI 0.42, 0.71)(趨勢的P值<0.001)[圖2B; 附錄表3]。
圖2MAFLD的患病率根據睡眠質量。根據(A)連續和(B)受限立方樣態分析定義的睡眠質量的MAFLD風險。多變量模型進行了年齡、性別、飲酒、吸煙、久坐時間、飲食多樣性、單身(是或否)、高等教育(是或否)、藥物治療(是或否)、高血壓(是或否)、糖尿病(是或否)和肥胖(是或否)的調整。對於睡眠質量,參考值是睡眠質量差。縮寫:MAFLD,代謝相關性脂肪肝疾病;OR,勝算比。
在定義的亞組中,睡眠質量與MAFLD風險之間的關聯
為了檢驗我們的研究結果的穩健性,進一步通過定義的亞組來研究睡眠質量與MAFLD風險之間的關聯[附錄表4 (16)]。睡眠質量與MAFLD風險之間的逆關係在男性和女性之間以及根據年齡和糖尿病、高血壓的盛行率不同而不同的亞組之間大致相似,但是對於女性、年輕參與者以及那些沒有既往糖尿病和高血壓的參與者,睡眠質量的中等下降對MAFLD風險產生了更大的影響[附錄表4 (16)]。相反,睡眠質量與中心性肥胖和久坐生活方式的存在似乎存在相互作用。當限制在沒有中心性肥胖和久坐時間較少的受試者時,睡眠質量對MAFLD風險的影響較小,而睡眠質量每提高1分,對體育不活躍的受試者[完全調整OR 0.80 (95% CI 0.72, 0.89)] 和中心性肥胖[完全調整OR 0.82 (95% CI 0.76, 0.87)] 的MAFLD風險分別減少約20%和18%。
此外,考慮了每個睡眠因子調整相對風險幅度的加權睡眠得分被用來評估睡眠質量與MAFLD風險之間的關係[附錄表5 (16)]。結果沒有實質性改變,即使是中等的睡眠質量改善也與完全調整後MAFLD風險的明顯減少相關。同樣,當限制在沒有使用睡眠藥物的受試者時,這種關聯仍然存在[附錄表6 (16)]。
身體質量指數(BMI)僅部分中介睡眠行為對MAFLD風險的影響
作為MAFLD發展的確立風險因素,BMI被發現與個別睡眠行為和整體睡眠質量都密切相關[附錄表7 (16)]。此外,即使在肥胖的調整後,睡眠行為與MAFLD風險之間的關聯仍然顯著[表2;附錄表3 (16)]。因此,我們試圖通過協變數調整的因果中介分析來探討BMI在這些睡眠行為和睡眠質量對MAFLD風險的影響中起到了多大程度的解釋作用[附錄圖2 (16)]。儘管睡眠質量通過BMI對MAFLD風險存在顯著的間接中介效應[−0.012 (95% CI −0.022, 0.000),P = 0.006](表4),但它僅解釋了睡眠質量對MAFLD風險的總效應的20.77%。在個別睡眠行為水平上,BMI幾乎中介了臥床和打鼾對MAFLD風險的總效應的一半(分別為臥床的46.97%和打鼾的52.50%),然而,失眠的直接效應和通過BMI對MAFLD風險的間接中介效應相反,導致失眠與MAFLD風險之間的關聯為空(表4)。值得注意的是,在所有這些睡眠行為中,打鼾,即阻塞性睡眠呼吸暫停的主要症狀(23),是唯一一個對MAFLD風險具有明顯直接影響的症狀(表4)。綜上所述,我們的結果表明,肥胖僅部分中介了整體睡眠質量對MAFLD的影響。
表4. 身體質量指數作為睡眠行為與代謝功能失調相關脂肪肝疾病風險之間中介因子的作用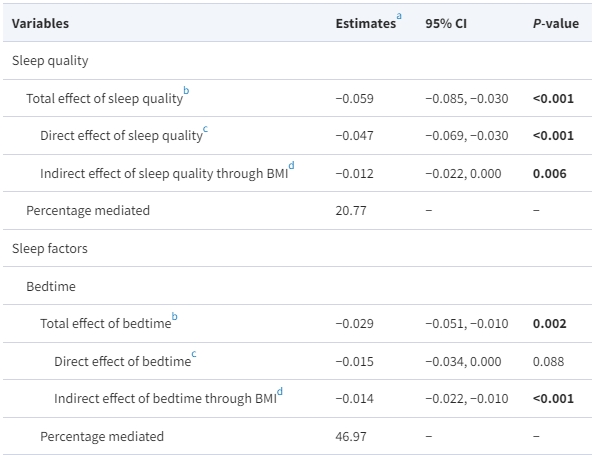
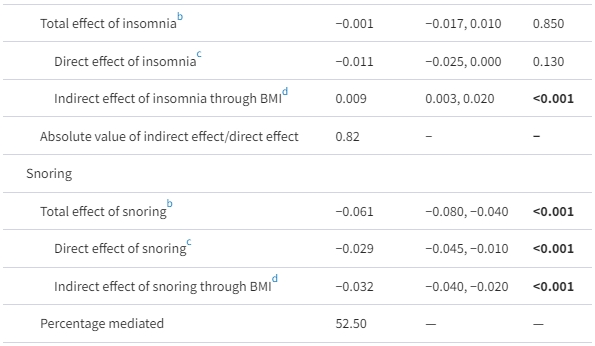
縮寫:BMI,身體質量指數;MAFLD,代謝功能失調相關脂肪肝疾病。
a 自訂5000次Bootstrap β係數(以非MAFLD組為參考,n=1000)。由於有缺失數據,僅使用具有完整數據的4983名受試者。分析已調整年齡、性別、飲酒、吸煙、久坐時間、飲食多樣性、是否單身、藥物治療(是或否)、高等教育(是或否)、高血壓(是或否)和糖尿病(是或否)。所有睡眠行為的維度(就寢時間、夜間睡眠時間、失眠、打鼾、白天過度嗜睡和白天打盹)均同時納入同一模型。
b 睡眠行為對MAFLD風險的影響,包括BMI(中介者)的影響。
c 睡眠行為對MAFLD風險的影響,不包括BMI(中介者)的影響。
d 睡眠行為對MAFLD風險的影響,通過BMI(中介者)的影響。
討論
在當代社會中,各種睡眠障礙無處不在,且經常被診斷不足和治療不當,導致新陳代謝失調的盛行率不斷上升。在這項針對中老年華人的橫斷面研究中,我們檢查了全面的睡眠行為,以健康睡眠分數的形式,與發展MAFLD的風險相關,並證明習慣性打鼾是導致MAFLD風險增加的最強睡眠障礙維度。此外,白天小睡無法緩解夜間睡眠障礙的有害影響。睡眠質量的中度改善可導致MAFLD風險降低29%。我們的發現呼籲公眾意識到睡眠行為,以減少MAFLD的風險。
睡眠是人類健康和幸福所必需的一個複雜、高度調控的過程。在所有主要的睡眠行為中,打鼾被發現是導致中老年華人MAFLD風險增加的最強因素,超出了肥胖的影響(表2和表3)。習慣性打鼾被報告與MAFLD的幾個組成部分密切相關,如糖尿病(8)和代謝綜合症(6)在不同人群中。值得注意的是,打鼾是阻塞性睡眠呼吸暫停的早期症狀,其特點是睡眠時上呼吸道的反復阻塞(23)。儘管很少有研究直接檢查打鼾與MAFLD之間的關係,但在睡眠呼吸暫停患者中,NAFLD的發病率和盛行率被發現顯著較高(24)。儘管對打鼾在MAFLD中的作用進行明確的功能性表徵還需要進一步的研究,我們假設生物學上間歇性低氧,由於頻繁的打鼾可能通過抑制肝脏線粒體中的脂肪酸氧化以及激活炎症和纖維化促進MAFLD的進展(25)。
睡眠持續時間是研究最廣泛的睡眠行為,儘管存在一些變異,但最近的一項綜合分析表明,睡眠時間短的個體患NAFLD的風險雖小但統計上顯著(4)。相比之下,我們的研究發現,不論是睡眠時間短還是長,都與MAFLD無關。值得注意的是,睡眠行為是相互聯繫的,總是協同作用的。短睡眠持續時間總是與晚睡和失眠密切相關(20)。與之前的報告一致,晚睡與NAFLD(10)、糖尿病(26)和肥胖(27)相關,我們發現晚睡與MAFLD風險之間存在直接的正相關,即使在完全調整後也是如此(表2),進一步凸顯了昼夜節律在調節系統代謝中的關鍵作用。最近,有報告稱,睡眠開始延遲與明顯較短的端粒長度和更快的端粒縮短速度相關(28),這是細胞衰老的經典標誌,進而促進MAFLD的進展(29)。與我們的發現相符,美國最近的一項研究也發現,以不合時宜的睡眠、晚睡或不規律的生物鐘類型定義的昼夜不協調與MAFLD獨立相關,而不是短睡眠時間(30)。總體來看,我們研究和其他研究的發現表明,睡眠持續時間的影響可能是由其他睡眠行為驅動的,除非同時改善睡眠的其他方面,否則僅增加睡眠持續時間的代謝益處將很小。
中國有中午小睡的獨特社會習慣,約61.7%的男性和46.8%的女性習慣午睡(22)。然而,到目前為止,白天小睡的代謝影響及其與夜間睡眠行為的交互作用仍有爭議。例如,在歐洲人(31)和日本人(32)中,分別觀察到由冠狀動脈心臟病導致的死亡風險降低,但心血管疾病死亡風險升高。與先前報告一致,更長的小睡時間與中老年華人的空腹血糖受損(33)和NAFLD(11)獨立相關,我們也發現延長小睡時間增加了MAFLD的風險。與最近在印度進行的一項實地研究相反,該研究發現小睡是對抗睡眠剝奪引起的認知障礙的有效干預策略(34),我們發現白天小睡無法抵消夜間睡眠質量差的代謝影響。更重要的是,白天小睡時間較長可能通過降低產熱和能量消耗(13)、增加交感神經活動(14)和促炎細胞因子的分泌(14),進一步增加MAFLD風險。
在這項研究中,我們新建立了一個健康睡眠分數,考慮了5個夜間睡眠因素與NAFLD(4, 10, 18, 24, 35, 36)以及白天小睡(11)(中國獨特的習慣)的綜合影響,以全面評估睡眠行為與MAFLD風險之間的關聯。除了最近專家共識聲明中包含的傳統風險因素(17)外,睡眠質量的中等改善就足以降低MAFLD的風險。儘管需要進行進一步的睡眠干預臨床試驗,以評估觀察到的關聯是否是因果關係,並且需要進行更多的機制研究,以闡明各種睡眠行為維度如何介導MAFLD的進展,但我們的發現強調了在預防MAFLD時考慮睡眠行為的重要性。從公共衛生的角度來看,我們研究提出的簡單健康睡眠分數算法為睡眠提供了一個積極的參考框架,也有助於識別高風險個體,促進健康管理。
此外,我們的研究還強調了女性可能比男性更容易受到睡眠質量差對MAFLD風險的影響。一些調查表明,睡眠行為對不良健康結果的影響因性別而異(13, 18)。儘管確切的生物介質仍然基本未知,但普遍認為絕經後雌激素水平下降可能起到作用。不出所料,久坐時間過長和中心性肥胖進一步惡化了睡眠質量差與MAFLD風險之間的關聯,表明不健康的生活方式和代謝共病對MAFLD的進展具有加成效應。有趣的是,在沒有高血壓的個體中,睡眠質量差對MAFLD風險的影響更為顯著。一個可能的解釋是,高血壓狀態下活化的腎素-血管緊張素系統淹沒了睡眠行為的效應,而針對腎素-血管緊張素系統的降壓藥可能對抵抗肝脂肪病變和氧化壓力產生一定的保護作用(37)。基於我們的結果,我們建議,無論是否存在代謝疾病,都應採取更多針對睡眠障礙的保護措施,並與其他生活方式干預措施一起採取,以遏制MAFLD的激增。
據我們所知,這是第一項全面評估一般人群中各種睡眠行為維度的研究。相對較大的樣本量和在居民社區中收集的自我報告症狀,使我們能夠在現實世界中檢查分層次組別之間的關聯,這可能增加了我們發現的普遍性。更重要的是,我們提出了一個簡單的健康睡眠分數,用於評估整體睡眠質量與MAFLD風險之間的關係,這整合了夜間睡眠行為和白天小睡。我們不知道是否有另一項類似的研究在探討這樣一個新穎的科學概念。然而,我們承認我們的研究存在幾個弱點和局限性。首先,由於這是一項橫斷面研究,無法推斷因果關係。儘管如此,我們的結果在幾項敏感性分析中都很穩健,並通過對潛在混淆變量的全面調整得到了加強。其次,由於我們的分析使用了自我報告的睡眠行為,所以難免會有分類錯誤和回憶偏差。然而,這種非差別的錯分類很可能會導致結果趨於無效,低估了觀察到的關聯的影響。第三,我們的研究中沒有考慮到一些可能影響睡眠質量的潛在因素,如晚餐時間、工作時間和其他家庭成員引起的睡眠干擾。然而,我們相信影響應該是最小的,因為這個隊列中很少有參與者遇到昼夜逆轉的睡眠。最後,肝脂肪變性是通過超聲波確定的,並未包括組織學證據,因為在基於人群的流行病學研究中進行侵入性檢測是不適當的(38)。到目前為止,超聲波仍然是基於人群的研究中最廣泛使用的脂肪肝一線診斷工具(3, 17, 18)。
總之,高質量睡眠,主要表現為早睡、從不或很少打鼾,以及短暫的白天小睡,與降低MAFLD風險相關,這種關聯部分是通過肥胖介導的。我們的發現呼籲公共衛生意識到睡眠障礙,以全面管理MAFLD風險。
討論
1. Eslam M, Sanyal AJ, George J, International Consensus Panel. MAFLD: a consensus-driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology. 2020;158(7):1999-2014 e1. doi:10.1053/j.gastro.2019.11.312
Google ScholarCrossrefWorldCat
2. Nan Y, An J, Bao J, et al. The Chinese Society of Hepatology position statement on the redefinition of fatty liver disease. J Hepatol. 2021;75(2):454-461. doi:10.1016/j.jhep.2021.05.003
Google ScholarCrossrefWorldCat
3. Zhou F, Zhou J, Wang W, et al. Unexpected rapid increase in the burden of NAFLD in China from 2008 to 2018: a systematic review and meta-analysis. Hepatology. 2019;70(4):1119-1133. doi:10.1002/hep.30702
Google ScholarCrossrefWorldCat
4. Wijarnpreecha K, Thongprayoon C, Panjawatanan P, Ungprasert P. Short sleep duration and risk of nonalcoholic fatty liver disease: a systematic review and meta-analysis. J Gastroenterol Hepatol. 2016;31(11):1802-1807. doi:10.1111/jgh.13391
Google ScholarCrossrefWorldCat
5. Li L, Gan Y, Zhou X, et al. Insomnia and the risk of hypertension: a meta-analysis of prospective cohort studies. Sleep Med Rev. 2021;56:101403.
Google ScholarCrossrefWorldCat
6. Ma J, Zhang H, Wang H, et al. Association between self-reported snoring and metabolic syndrome: a systematic review and meta-analysis. Front Neurol. 2020;11:517120. doi:10.3389/fneur.2020.517120
Google ScholarCrossrefWorldCat
7. Koopman ADM, Beulens JW, Dijkstra T, et al. Prevalence of insomnia (symptoms) in T2D and association with metabolic parameters and glycemic control: meta-analysis. J Clin Endocrinol Metab. 2020;105(3):614-643. Doi: 10.1210/clinem/dgz065
Google ScholarWorldCat
8. Xiong X, Zhong A, Xu H, Wang C. Association between self-reported habitual snoring and diabetes mellitus: a systemic review and meta-analysis. J Diabetes Res. 2016;2016:1958981. doi:10.1155/2016/1958981
Google ScholarCrossrefWorldCat
9. Haaramo P, Rahkonen O, Hublin C, Laatikainen T, Lahelma E, Lallukka T. Insomnia symptoms and subsequent cardiovascular medication: a register-linked follow-up study among middle-aged employees. J Sleep Res. 2014;23(3):281-289. doi:10.1111/jsr.12116
Google ScholarCrossrefWorldCat
10. Wang H, Gu Y, Zheng L, et al. Association between bedtime and the prevalence of newly diagnosed non-alcoholic fatty liver disease in adults. Liver Int. 2018;38(12):2277-2286. doi:10.1111/liv.13896
Google ScholarCrossrefWorldCat
11. Peng K, Lin L, Wang Z, et al. Short sleep duration and longer daytime napping are associated with non-alcoholic fatty liver disease in Chinese adults. J Diabetes. 2017;9(9):827-836. doi:10.1111/1753-0407.12489
Google ScholarCrossrefWorldCat
12. Faraut B, Nakib S, Drogou C, et al. Napping reverses the salivary interleukin-6 and urinary norepinephrine changes induced by sleep restriction. J Clin Endocrinol Metab. 2015;100(3):E416-E426. doi:10.1210/jc.2014-2566
Google ScholarCrossrefWorldCat
13. Wang N, Zou J, Fang S, Zhou J. Association between daytime napping and obesity in Chinese middle-aged and older adults. J Glob Health. 2020;10(2):020804. doi:10.7189/jogh.10.020804
Google ScholarCrossrefWorldCat
14. Yamada T, Shojima N, Yamauchi T, Kadowaki T. J-curve relation between daytime nap duration and type 2 diabetes or metabolic syndrome: a dose-response meta-analysis. Sci Rep. 2016;6:38075. doi:10.1038/srep38075
Google ScholarCrossrefWorldCat
15. Muscogiuri G, Barrea L, Annunziata G, et al. Obesity and sleep disturbance: the chicken or the egg? Crit Rev Food Sci Nutr. 2019;59(13):2158-2165. doi:10.1080/10408398.2018.1506979
Google ScholarCrossrefWorldCat
16. Yang J, Shiyun L, Li R. Data from: sleep factors in relation to metabolic-dysfunction associated fatty liver disease in middle-aged and elderly Chinese. Uploaded June 6, 2022. FigShare. https://figshare.com/articles/dataset/Supplementary_data_R1_pdf/19948949
17. Eslam M, Newsome PN, Sarin SK, et al. A new definition for metabolic dysfunction-associated fatty liver disease: an international expert consensus statement. J Hepatol. 2020;73(1):202-209. doi:10.1016/j.jhep.2020.03.039
Google ScholarCrossrefWorldCat
18. Kim C-W, Yun KE, Jung H-S, et al. Sleep duration and quality in relation to non-alcoholic fatty liver disease in middle-aged workers and their spouses. J Hepatol. 2013;59(2):351-357. doi:10.1016/j.jhep.2013.03.035
Google ScholarCrossrefWorldCat
19. Mathiesen UL, Franzén LE, Aselius H, et al. Increased liver echogenicity at ultrasound examination reflects degree of steatosis but not of fibrosis in asymptomatic patients with mild/moderate abnormalities of liver transaminases. Dig Liver Dis. 2002;34(7):516-522. doi:10.1016/s1590-8658(02)80111-6
Google ScholarCrossrefWorldCat
20. Fan M, Sun D, Zhou T, et al. Sleep patterns, genetic susceptibility, and incident cardiovascular disease: a prospective study of 385 292 UK biobank participants. Eur Heart J. 2020;41(11):1182-1189. doi:10.1093/eurheartj/ehz849
Google ScholarCrossrefWorldCat
21. Liu C, Zhong R, Lou J, et al. Nighttime sleep duration and risk of nonalcoholic fatty liver disease: the Dongfeng-Tongji prospective study. Ann Med. 2016;48(6):468-476. doi: 10.1080/07853890.2016.1193787
Google ScholarCrossrefWorldCat
22. Wu J, Xu G, Shen L, et al. Daily sleep duration and risk of metabolic syndrome among middle-aged and older Chinese adults: cross-sectional evidence from the Dongfeng-Tongji cohort study. BMC Public Health. 2015;15:178. doi:10.1186/s12889-015-1521-z
Google ScholarCrossrefWorldCat
23. Campos AI, García-Marín LM, Byrne EM, Martin NG, Cuéllar-Partida G, Rentería ME. Insights into the aetiology of snoring from observational and genetic investigations in the UK Biobank. Nat Commun. 2020;11(1):817. doi:10.1038/s41467-020-14625-1
Google ScholarCrossrefWorldCat
24. Mesarwi OA, Loomba R, Malhotra A. Obstructive sleep apnea, hypoxia, and nonalcoholic fatty liver disease. Am J Respir Crit Care Med. 2019;199(7):830-841. doi:10.1164/rccm.201806-1109TR
Google ScholarCrossrefWorldCat
25. Orr WC, Fass R, Sundaram SS, Scheimann AO. The effect of sleep on gastrointestinal functioning in common digestive diseases. Lancet Gastroenterol Hepatol. 2020;5(6):616-624. doi:10.1016/S2468-1253(19)30412-1
Google ScholarCrossrefWorldCat
26. Yan B, Fan Y, Zhao B, et al. Association between late bedtime and diabetes mellitus: a large community-based study. J Clin Sleep Med. 2019;15(11):1621-1627. doi:10.5664/jcsm.8026
Google ScholarCrossrefWorldCat
27. Tse LA, Wang C, Rangarajan S, et al. Timing and length of nocturnal sleep and daytime napping and associations with obesity types in high-, middle-, and low-income countries. JAMA Netw Open. 2021;4(6):e2113775. doi:10.1001/jamanetworkopen.2021.13775
Google ScholarCrossrefWorldCat
28. Wynchank D, Bijlenga D, Penninx BW, et al. Delayed sleep-onset and biological age: late sleep-onset is associated with shorter telomere length. Sleep. 2019;42(10):zsz139. Doi: 10.1093/sleep/zsz139
Google ScholarWorldCat
29. Papatheodoridi A-M, Chrysavgis L, Koutsilieris M, Chatzigeorgiou A. The role of senescence in the development of nonalcoholic fatty liver disease and progression to nonalcoholic steatohepatitis. Hepatology. 2020;71(1):363-374. doi:10.1002/hep.30834
Google ScholarCrossrefWorldCat
30. Weng Z, Ou W, Huang J, et al. Circadian misalignment rather than sleep duration is associated with MAFLD: a population-based propensity score-matched study. Nat Sci Sleep. 2021;13:103-111. doi:10.2147/NSS.S290465
Google ScholarCrossrefWorldCat
31. Naska A, Oikonomou E, Trichopoulou A, Psaltopoulou T, Trichopoulos D. Siesta in healthy adults and coronary mortality in the general population. Arch Intern Med. 2007;167(3):296-301. doi:10.1001/archinte.167.3.296
Google ScholarCrossrefWorldCat
32. Tanabe N, Iso H, Seki N, et al. Daytime napping and mortality, with a special reference to cardiovascular disease: the JACC study. Int J Epidemiol. 2010;39(1):233-243. doi:10.1093/ije/dyp327
Google ScholarCrossrefWorldCat
33. Fang W, Li Z, Wu L, et al. Longer habitual afternoon napping is associated with a higher risk for impaired fasting plasma glucose and diabetes mellitus in older adults: results from the Dongfeng-Tongji cohort of retired workers. Sleep Med. 2013;14(10):950-954. doi:10.1016/j.sleep.2013.04.015
Google ScholarCrossrefWorldCat
34. Rao G, Redline S, Schilbach F, Schofield H, Toma M. Informing sleep policy through field experiments. Science. 2021;374(6567):530-533. doi:10.1126/science.abk2594
Google ScholarCrossrefWorldCat
35. Yu JH, Ahn JH, Yoo HJ, et al. Obstructive sleep apnea with excessive daytime sleepiness is associated with non-alcoholic fatty liver disease regardless of visceral fat. Korean J Intern Med. 2015;30(6):846-855. doi:10.3904/kjim.2015.30.6.846
Google ScholarCrossrefWorldCat
36. Wijarnpreecha K, Thongprayoon C, Panjawatanan P, Ungprasert P. Insomnia and risk of nonalcoholic fatty liver disease: a systematic review and meta-analysis. J Postgrad Med. 2017;63(4):226-231. doi:10.4103/jpgm.JPGM_140_17
Google ScholarCrossrefWorldCat
37. Wei Y, Clark SE, Morris EM, et al. Angiotensin II-induced non-alcoholic fatty liver disease is mediated by oxidative stress in transgenic TG(mRen2)27(Ren2) rats. J Hepatol. 2008;49(3):417-428. doi:10.1016/j.jhep.2008.03.018
Google ScholarCrossrefWorldCat
38. Joy D, Thava VR, Scott BB. Diagnosis of fatty liver disease: is biopsy necessary? Eur J Gastroenterol Hepatol. 2003;15(5):539-543. doi:10.1097/01.meg.0000059112.41030.2e
Google ScholarWorldCat



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย