最新研究揭示,在慢性腎病晚期患者中,NT-proBNP(N末端前腦利尿肽)水平與體液狀態之間的交互作用與不良臨床結果密切相關。研究顯示,NT-proBNP水平較高且體液過多的患者,相較於NT-proBNP水平較低且體液未過多的患者,開始透析的風險顯著增加。此外,高NT-proBNP水平與體液過多的患者比其他患者更容易發生主要不良心血管事件或全因死亡。這項研究強調了在慢性腎病晚期患者的臨床護理中考慮NT-proBNP與體液狀態交互作用的重要性,並可能提供更精確的預測臨床結果的方法。
本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
N-末端前腦利鈉肽與液體狀態在慢性腎病晚期不良臨床結果中的相互作用
The interaction between N-terminal pro-brain natriuretic peptide and fluid status in adverse clinical outcomes of late stages of chronic kidney disease
Yi-Chun Tsai,Hui-Ju Tsai,Chee-Siong Lee,Yi-Wen Chiu,Hung-Tien Kuo,Su-Chu Lee,Tzu-Hui Chen,Mei-Chuan Kuo
Published: August 22, 2018
https://doi.org/10.1371/journal.pone.0202733
Abstract
Introduction
Fluid overload is one of the major characteristics and complications in patients with chronic kidney disease (CKD). N-terminal pro-brain natriuretic peptide (NT-proBNP) is related to fluid status and fluid distribution. The aim of this study is to investigate the interaction between NT-proBNP and fluid status in adverse clinical outcomes of late stages of CKD.
Methods
We enrolled 239 patients with CKD stages 4–5 from January 2011 to December 2011 and followed up until June 2017. Fluid status was presented as hydration status (HS) value measured by body composition monitor, while HS>7% was defined as fluid overload. Clinical outcomes included renal outcomes (commencing dialysis and estimated glomerular filtration rate decline>3 ml/min/1.73 m2/year), all-cause mortality and major adverse cardiovascular events (MACEs).
Results
During a mean follow-up of 3.3±2.0 years, 129(54.7%) patients commenced dialysis, 88(37.3%) patients presented rapid renal function decline, and 48(20.3%) had MACEs or died. All patients were stratified by HS of 7% and the median of plasma NT-proBNP. The adjusted risks for commencing dialysis was significantly higher in patients with high plasma NT-proBNP and HS>7% compared to those with low plasma NT-proBNP and HS≦7%. There was a significant interaction between plasma NT-proBNP and HS in commencing dialysis (P-interaction = 0.047). Besides, patients with high plasma NT-proBNP and HS>7% had greater risks for MACEs or all-cause mortality than others with either high plasma NT-proBNP or HS>7%.
Conclusion
NT-proBNP and fluid overload might have a synergistic association of adverse clinical outcomes in patients with late stages of CKD.
摘要
引言
液體過載是慢性腎病(CKD)患者的主要特徵及併發症之一。N-末端前腦利鈉肽(NT-proBNP)與液體狀態和液體分布有關。本研究旨在探討NT-proBNP與液體狀態在CKD晚期不良臨床結果中的相互作用。
方法
我們自2011年1月至2011年12月招募了239名第4-5期CKD患者,並追蹤至2017年6月。液體狀態以身體組成監測儀測量的水合狀態(HS)值呈現,而HS>7%定義為液體過載。臨床結果包括腎功能結果(開始透析和估計的腎小球過濾率每年下降>3毫升/分/1.73平方米)、所有原因死亡率和主要不良心血管事件(MACEs)。
結果
在平均追蹤3.3±2.0年期間,129名(54.7%)患者開始透析,88名(37.3%)患者出現快速腎功能下降,48名(20.3%)發生MACEs或死亡。所有患者根據HS的7%和血浆NT-proBNP的中位數進行分層。與血浆NT-proBNP和HS≦7%的患者相比,高血浆NT-proBNP和HS>7%的患者開始透析的調整風險顯著增加。血浆NT-proBNP和HS在開始透析中存在顯著的相互作用(P-交互作用=0.047)。此外,血浆NT-proBNP和HS>7%較高的患者比其他高血浆NT-proBNP或HS>7%的患者有更大的MACEs或所有原因死亡率風險。
結論
NT-proBNP和液體過載可能在CKD晚期患者的不良臨床結果中有協同關聯。
引言
腦利鈉肽(BNP)是一種在左心室(LV)壁壓力和伸展增加時由心肌細胞合成的心臟神經激素[1, 2]。Pre-proBNP從BNP釋放出來,隨後被裂解成proBNP,進一步裂解成生物活性的BNP和非活性的N-末端前腦利鈉肽(NT-proBNP)[3, 4]。NT-proBNP不僅被視為左心室功能障礙的生物標誌物[5],同時也是透析患者主要不良心血管事件(MACEs)和所有原因死亡率的預測因子[6, 7]。在未進行透析的慢性腎病(CKD)患者中,越來越多的證據顯示血漿NT-proBNP水平與所有原因死亡率和MACEs有顯著關聯[8–10]。此外,血漿NT-proBNP水平升高表明初次透析的風險增加[11, 12]。NT-proBNP已成為無論是否進行透析的CKD患者不良臨床結果的潛在生物標誌物。
液體過載是CKD患者的主要特徵和併發症之一。液體過載與腎功能快速下降和心血管事件或所有原因死亡率風險增加顯著相關[13, 14]。血漿BNP與液體狀態[15]和細胞內水(ICW)與細胞外水(ECW)之間的液體分布有關[16]。NT-proBNP與液體狀態之間的相互作用可能與不良臨床結果相關。NT-proBNP和液體狀態可能在CKD患者的預後意義上有協同效應。因此,本研究的目的是評估NT-proBNP與液體狀態之間的相互作用是否與未進行透析的第4-5期CKD患者開始透析、MACEs和所有原因死亡率等不良臨床結果相關。
材料與方法
研究參與者
邀請了239名第4-5期慢性腎病(CKD)患者於2011年1月至2011年12月在台灣南部的一家醫院參加這項研究。根據腎臟病結果質量倡議(K/DOQI)的定義對CKD進行分期,並使用4變量膳食在腎病中的修改(MDRD)研究的方程式計算估計的腎小球過濾率(eGFR)(CKD第4期,eGFR:15–29毫升/分/1.73m^2;CKD第5期,eGFR<15毫升/分/1.73m^2)[17]。本研究的排除標準包括eGFR≥30毫升/分/1.73m^2的患者和有惡性腫瘤底線疾病的患者。由於eGFR斜率計算的最低要求,我們還排除了在隨訪期間少於三次eGFR測量的三名患者。本研究協議已獲得高雄醫學大學醫院倫理委員會(KMUH-IRB-990125)的批准。方法按照相關指南執行,包括任何相關細節,如研究設計的低風險、私隱保護和安全管理。從患者處獲得了書面形式的知情同意,所有臨床調查都根據《赫爾辛基宣言》表達的原則進行。
循環NT-proBNP的定量
在入組時收集了血樣。所有血樣在招募完成後分裝並儲存在-80°C的冷凍庫中,以供分析NT-proBNP使用。使用基於製造商說明書的商業酶聯免疫吸附試驗(Elecsys® Roche)以雙重測定法測量血漿NT-proBNP。NT-proBNP測試的報告範圍為5-35000 pg/mL,NT-proBNP的試驗內和試驗間變異系數分別為1.03%和2.56%。
測量液體狀態
液體狀態是在入組時通過身體成分監測器(BCM, Fresenius Medical Care)測量一次,這是一種生物阻抗譜方法,如我們之前的研究[13, 14]。BCM根據每種組織的阻抗差異,通過3組分組織模型[18, 19]提供正常水化的瘦組織、正常水化的脂肪組織和全身過剩液體質量的數據。過水化(OH)值作為一個絕對的液體狀態,可以從正常預期的和實際測量的細胞外水(ECW)之間的差異計算出來[19]。BCM可以更精確地檢測體內液體隔室,並已在普通人群和進行透析的CKD患者中得到驗證[20–22]。液體狀態也在未進行透析的CKD患者中得到驗證,而洪等人將液體過載定義為水合狀態(HS, OH/ECW)值超過7%[20]。因此,在本研究中,我們將液體過載定義為HS>7%。
資料收集
參與者被要求在收集血液樣本進行生化研究前至少禁食12小時,並通過尿蛋白-肌酐比(PCR)測量尿中蛋白質。入組時,從醫療記錄和與患者的訪談中獲取人口學和臨床數據。從醫療記錄中獲取了入組前3個月內患者使用的包括利尿劑、β-阻滯劑、鈣通道阻滯劑、血管緊張素轉換酶抑制劑(ACEI)、血管緊張素II受體阻滯劑(ARB)和他汀類藥物的信息。根據美國糖尿病協會的標準、口服降糖藥物的使用或胰島素的使用,通過病史和血糖值將患者分類為糖尿病患者。心血管疾病定義為急性或慢性缺血性心臟病、心肌梗塞和心力衰竭的病史。腦血管疾病定義為腦梗塞或出血的病史。
臨床結果
參與者每隔三個月在門診接受聯繫,以評估臨床狀態。腎臟結果包括開始透析(血液透析或腹膜透析)和快速腎功能下降。開始透析是通過審查災難性疾病證明(由台灣國家健康保險局發行)和醫療記錄確認的。快速腎功能下降定義為每年eGFR下降> 3 ml/min/1.73 m^2(eGFR斜率)。eGFR斜率是基於從入組到觀察期結束的所有可用eGFR值,按每年ml/min/1.73 m^2的單位計算eGFR和時間之間的回歸系數。估計eGFR斜率至少需要三個eGFR值。快速eGFR下降被定義為最低四分位數(eGFR每年下降超過3 ml/min/1.73m^2,接近最低兩個四分位數之間截點的整數)[13]。主要不良心血管事件(MACEs)定義為新發心肌梗塞、不穩定型心絞痛、急性出血性或缺血性中風、與急性期充血性心力衰竭或心律不齊相關的住院治療。通過直接聯繫患者和家屬獲取的死亡信息,進一步通過審查醫療記錄和篩查國家死亡檔案數據庫進行補充。我們排除了開始透析後的MACEs或死亡。患者在最後聯繫或2017年6月觀察結束時被設為觀察終點。
統計分析
根據水合狀態(HS)值7%和循環NT-proBNP的中位數,將研究人群進一步分為四組。連續變量以平均值±標準差或中位數(第25,第75百分位)表示,視情況而定,類別變量以百分比表示。偏態分布的連續變量進行對數轉換以達到正常分布。使用單因素變異數分析(ANOVA)後接Bonferroni校正的事後測試或Kruskal-Wallis H測試檢測組間連續變量的差異,視情況而定。使用卡方檢測檢測類別變量分布的差異。通過線性回歸檢查液體狀態與NT-proBNP之間的關聯。使用Kaplan-Meier生存曲線進行時間至事件生存分析,測試液體狀態或循環NT-proBNP水平作為開始透析和MACEs或所有原因死亡率風險的預測因子。利用Cox回歸模型評估開始透析中液體狀態和循環NT-proBNP水平之間的交互作用。還使用多變量邏輯回歸模型檢查快速腎功能下降與液體狀態和循環NT-proBNP水平之間的交互作用的關聯。年齡、性別、糖尿病、心血管疾病、利尿劑使用、ACEI/ARB使用、eGFR和尿PCR在多變量分析中被選為腎臟結果的因素。除上述參數外,他汀類藥物使用和低密度脂蛋白被納入MACEs或所有原因死亡率的多變量分析。利用交互作用P值分析所有患者中液體狀態和循環NT-proBNP對臨床結果是否存在協同效應。統計分析使用SPSS 18.0 for Windows(SPSS Inc.,芝加哥,伊利諾伊州)進行。統計顯著性設定為雙側P值小於0.05。
結果
整個隊列的特徵
基於水合狀態(HS)值7%和循環NT-proBNP水平(261.8pg/ml)的中位數,各組臨床特徵的比較如表1所示。所有患者中,平均年齡為64.9±11.8歲,53.0%為男性,HS的平均值為7.8%。93名(39.4%)和39名(16.5%)分別患有糖尿病和心血管疾病。與其他組相比,HS>7%和高循環NT-proBNP水平的患者有最高比例的腦血管疾病和接受鈣通道阻滯劑、β-阻滯劑和利尿劑的治療。收縮壓、血尿素氮和尿PCR更高,而舒張壓、eGFR、血清白蛋白、血紅蛋白和鈣水平在HS>7%和高循環NT-proBNP水平的患者中比其他組低(表1)。
表1. 根據血漿N-末端前腦利鈉肽(NT-proBNP)和液體狀態分層的研究對象臨床特徵。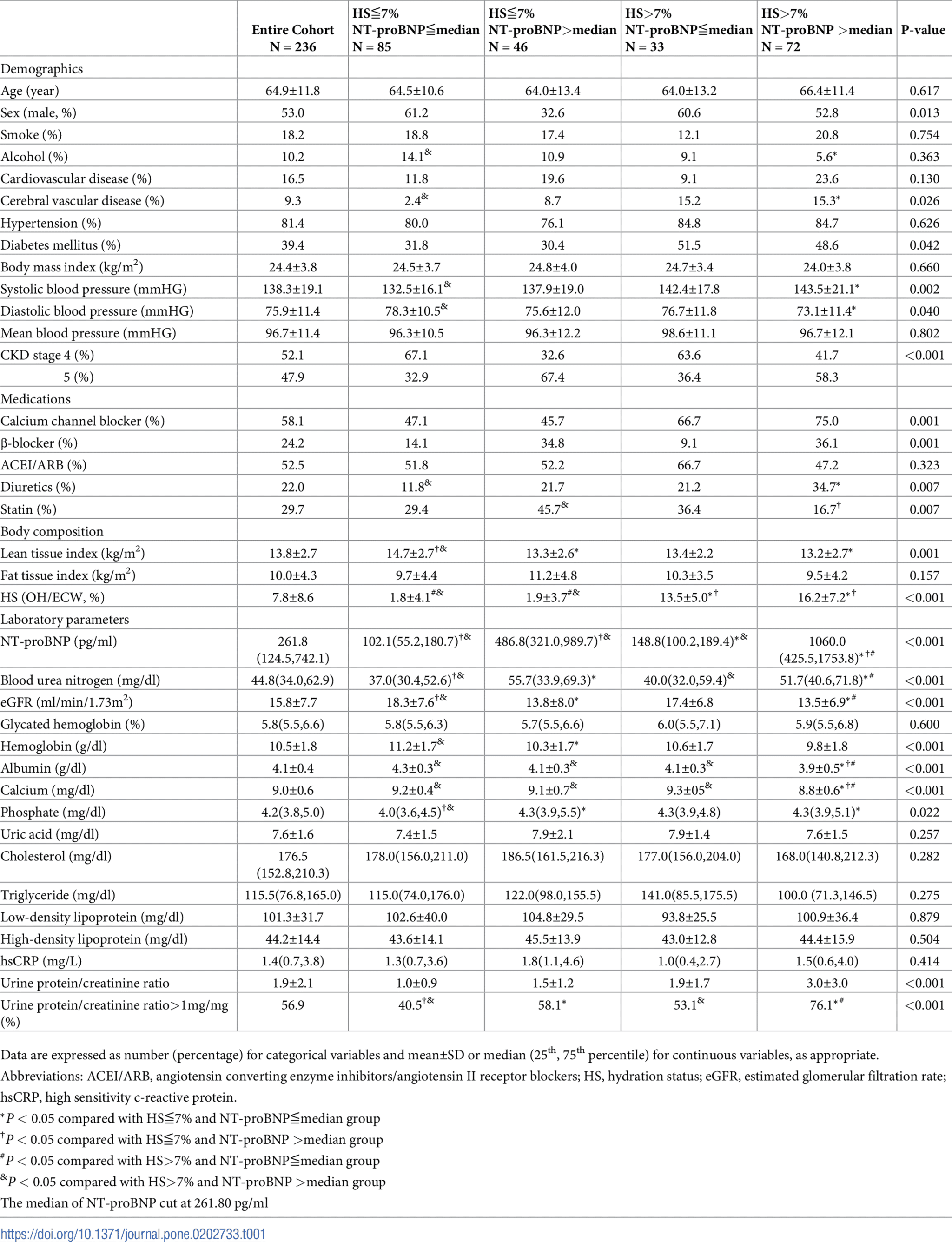
NT-proBNP與液體狀態之間的相關性
循環NT-proBNP與液體狀態之間的正相關顯示在圖1中。在多變量線性回歸中,升高的NT-proBNP水平與高HS顯著相關(未標準化β:4.24,95%置信區間(CI):2.44–6.05,P<0.001)(表2)。與循環NT-proBNP水平的最低三分位數相比,循環NT-proBNP水平的最高三分位數與HS有顯著關聯(未標準化β:3.96,95%CI:1.25–6.66,P = 0.004),校正了年齡、性別、糖尿病、心血管疾病、利尿劑使用、eGFR、尿PCR以及血清白蛋白和血紅蛋白水平後。循環NT-proBNP水平與液體狀態之間存在劑量依賴性相關。
圖1. 血漿N-末端前腦利鈉肽(NT-proBNP)與液體狀態之間的相關性。 表2. 血漿N-末端前腦利鈉肽(NT-proBNP)與液體狀態的關聯。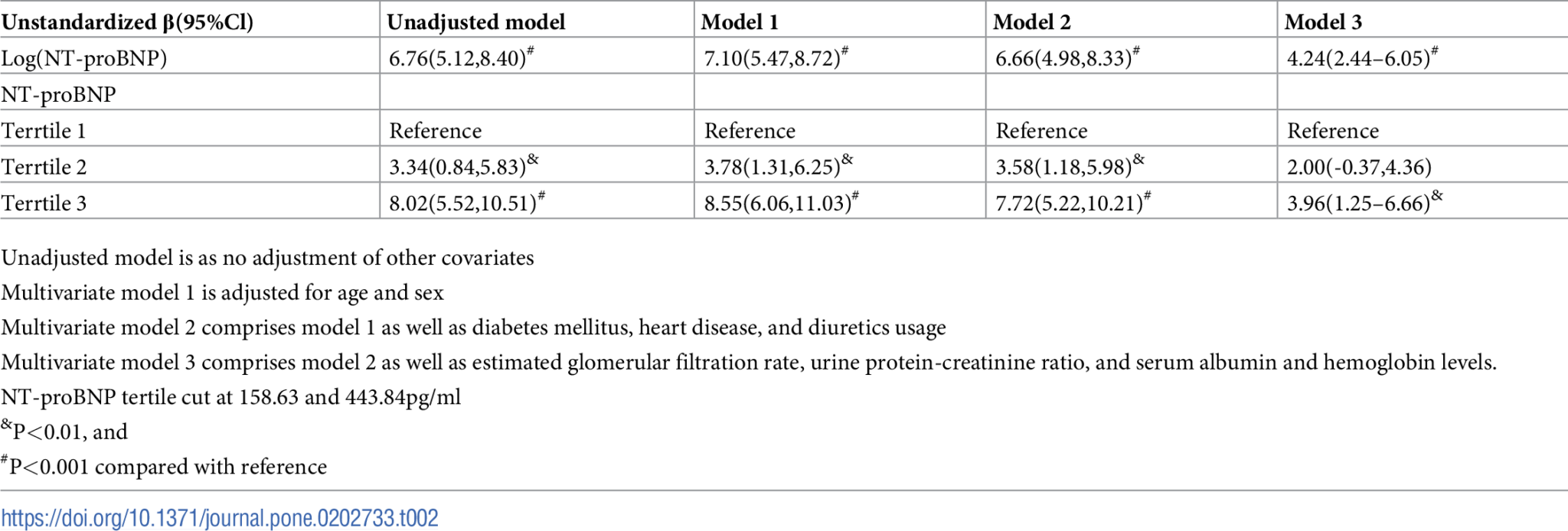
液體狀態、NT-proBNP與腎臟結果
在平均3.3±2.0年的隨訪期間,共有129名患者(54.7%)開始透析(表3)。在4組中,HS>7%和高循環NT-proBNP水平的患者開始透析的比例最高(P = 0.043,表3)。Kaplan-Meier曲線顯示,與其他人相比,HS>7%和高循環NT-proBNP水平的患者更有可能開始透析(圖2A)。我們進一步分析了液體狀態和循環NT-proBNP水平在開始透析中的交互作用(表4)。與HS≦7%和低循環NT-proBNP水平的患者相比,HS>7%和高循環NT-proBNP水平的患者開始透析的未調整和調整後風險比(HR)分別為3.32(95% CI: 2.14–5.16)和1.71(95% CI: 1.03–2.85)。在第4-5期CKD患者中,液體狀態和循環NT-proBNP與開始透析存在顯著的協同關聯(HR: 2.09,95%CI: 1.01–4.30,P-交互作用 = 0.047)。
圖2. 根據血漿N-末端前腦利鈉肽(NT-proBNP)和液體狀態分層的研究對象,針對(A)開始透析和(B)主要不良心血管事件或所有原因死亡的Kaplan-Meier生存曲線。 表3. 根據血漿N-末端前腦利鈉肽(NT-proBNP)和液體狀態分層的研究對象事件。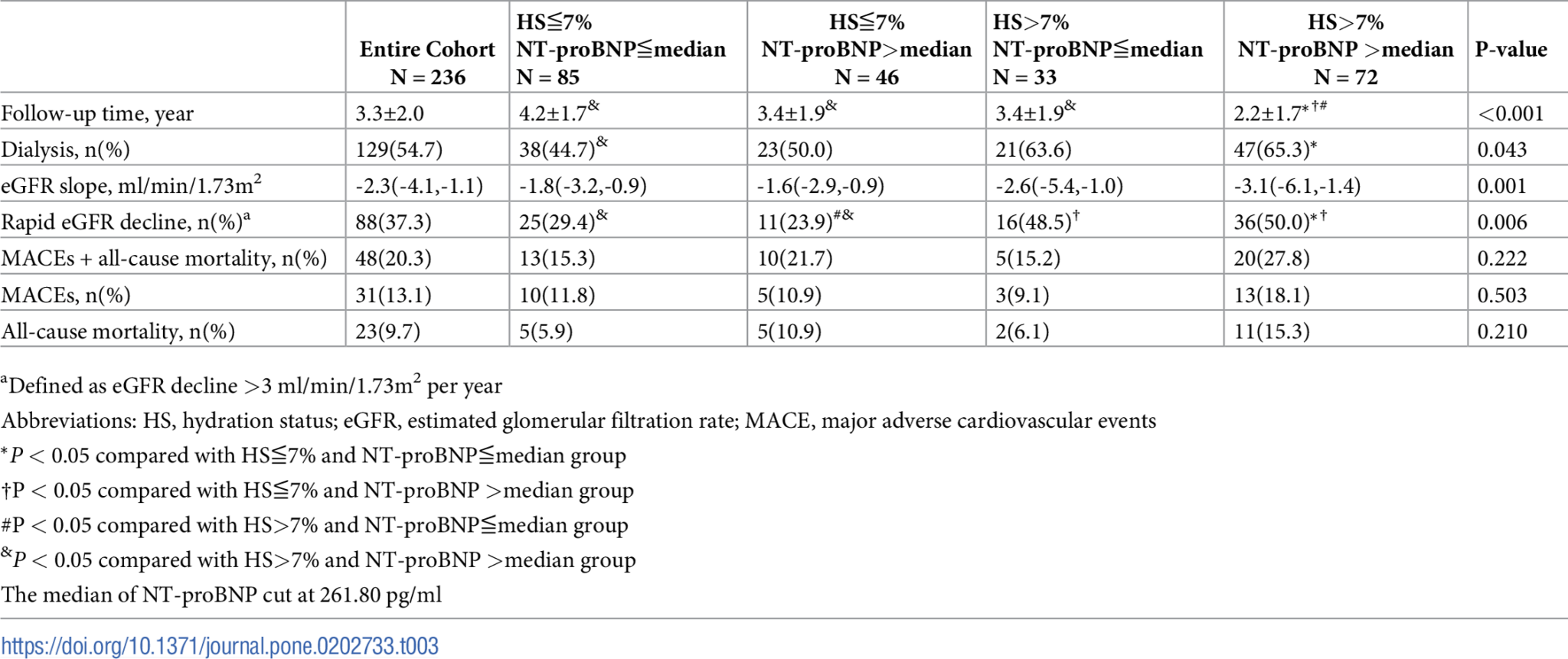
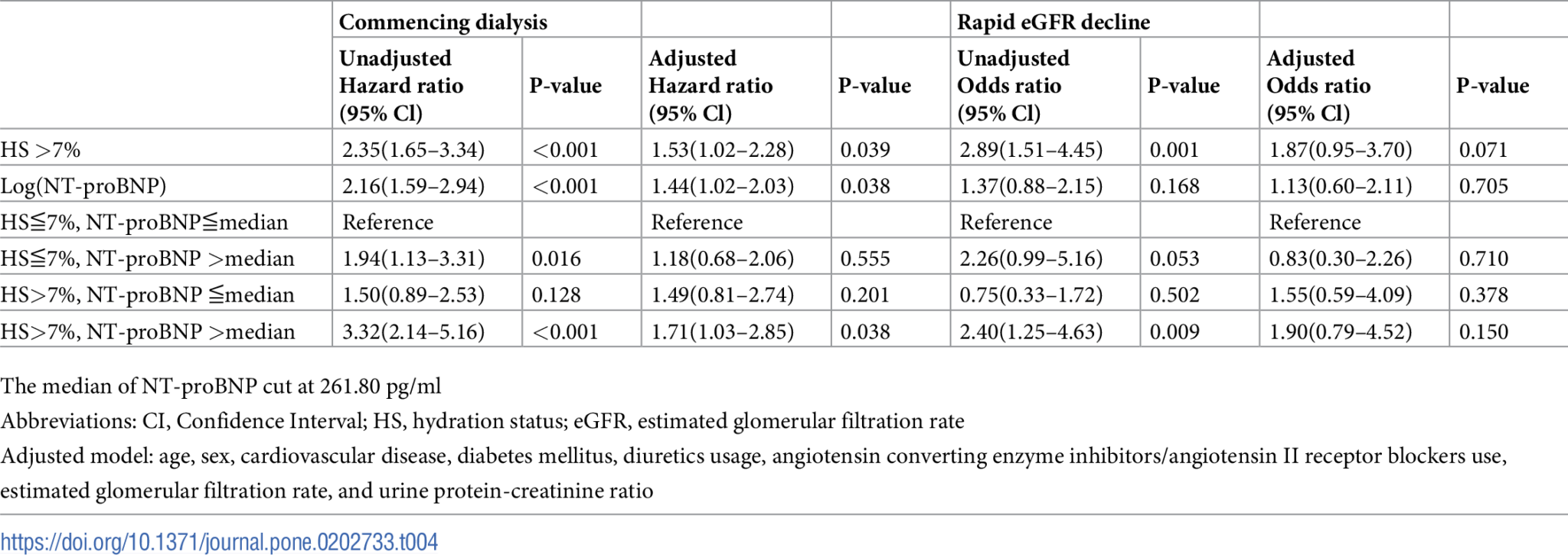
在隨訪期間,有88名(37.3%)患者出現快速eGFR下降。圖3顯示了eGFR下降與HS或NT-proBNP之間的負相關。在四個組別中,HS>7%和高循環NT-proBNP水平的患者腎功能下降最大(eGFR斜率:-3.1(-6.1,-1.4)mL/min/1.73 m^2/年,表3)。在未調整模型中,HS>7%和高循環NT-proBNP與快速eGFR下降有協同關聯(2.40,95% CI:1.25–4.63),但在調整後分析中則沒有(表4)。在快速腎功能下降中,HS和循環NT-proBNP水平之間沒有顯著交互作用(P-交互作用=0.527)。
圖3. eGFR下降與(A)液體狀態和(B)血漿N-末端前腦利鈉肽(NT-proBNP)的關聯。液體狀態、NT-proBNP、MACEs及所有原因死亡率
在所有患者中,48名患者(20.3%)在開始透析前達到MACEs或所有原因死亡(表3)。在隨訪期間,31名患者發生MACEs,23名死亡,6名同時發生MACEs和死亡。死亡原因包括三起心血管事件、11起敗血症、三起惡性腫瘤、三起拒絕透析,其餘為其他原因的混合。MACEs的原因包括9起急性心肌梗塞、9起急性出血性或缺血性中風、12次因充血性心力衰竭住院、一起病竇綜合症和一起主動脈夾層。四組之間在MACEs和所有原因死亡率的比例上沒有顯著差異。
與其他人相比,HS>7%和高循環NT-proBNP水平的患者達到MACEs或所有原因死亡率的風險更高(圖2B)。不僅HS(HR:1.08,95%CI:1.03–1.13)而且對數轉換後的NT-proBNP(HR:2.51,95%CI:1.27–4.95)與MACEs或所有原因死亡率的綜合結果顯著相關(表5)。在MACEs或所有原因死亡率單獨進行的cox比例和多變量分析中也保持一致的顯著性。與HS≦7%和低循環NT-proBNP水平的患者相比,HS>7%和高循環NT-proBNP水平的患者在MACEs或所有原因死亡率的綜合結果的調整後風險比為2.41(95% CI:1.01–5.77)。然而,在僅MACEs或所有原因死亡率的分析中沒有顯著結果。在MACEs或所有原因死亡率中沒有發現HS和循環NT-proBNP水平之間的顯著交互作用。
表5. 根據血漿N-末端前腦利鈉肽(NT-proBNP)和液體狀態調整後的主要不良心血管事件(MACEs)和所有原因死亡率的風險。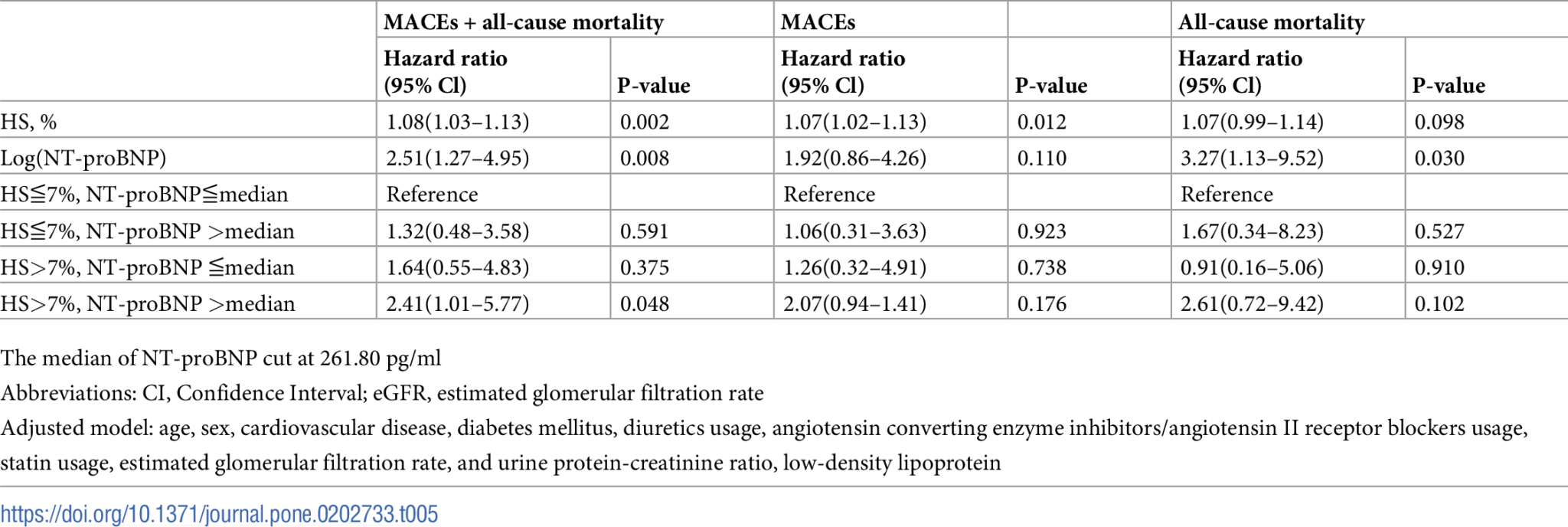
討論
本研究評估了血漿NT-proBNP水平與液體狀態在慢性腎病(CKD)第4-5期患者不良臨床結果中的相互作用,觀察期為3.3年。與僅有液體過載或高血漿NT-proBNP水平的患者相比,同時有液體過載和高血漿NT-proBNP水平的CKD患者開始透析和MACEs或所有原因死亡率的風險更高。NT-proBNP和液體過載在預測CKD晚期的不良臨床結果方面具有協同作用。
液體過載導致心肌細胞伸長,進而導致左心室(LV)重塑和失代償[23,24]。然後,BNP將響應LV壁的增加壓力和伸展而由心肌細胞合成[1,2]。因此,NT-proBNP水平被認為是血管內液體狀態的指標[25, 26]。NT-proBNP還與細胞內水(ICW)和細胞外水(ECW)之間的液體容量不平衡相關[16]。我們的結果發現,同時有高HS和高NT-proBNP的患者比僅有高NT-proBNP無高HS的患者有更高的NT-proBNP水平,意味著液體狀態對NT-proBNP增加有影響。越來越多的證據表明腎功能影響循環NT-proBNP水平[27]。腎功能惡化增加NT-proBNP/BNP比率[27]。此外,潛在的心血管疾病也對NT-proBNP水平有影響。因此,我們在調整模型中加入基線腎功能和心血管疾病進行分析,結果顯示液體過載與NT-proBNP之間有密切相關。NT-proBNP與液體狀態呈正相關,獨立於腎功能和潛在心血管疾病,在CKD晚期。
NT-proBNP和液體過載共享許多心腎綜合症的病理生理機制,如腎素-血管緊張素-醛固酮系統(RAAS)的過度激活、免疫系統受損和炎症等[20, 28–31]。RAAS的激活涉及到LV功能的損害,導致NT-proBNP升高[28],RAAS還通過調節血壓和液體狀態來調節血流動力學穩定[30]。促炎細胞因子白介素-1β和腫瘤壞死因子-α導致BNP基因表達和分泌的選擇性增加[31],NT-proBNP與炎症標誌物,如白介素-6和CRP相關[32,33]。另外,炎症與液體狀態密切相關[20]。液體過載增加腸道通透性,進一步破壞保護屏障,導致病原物種過度生長[34]。因此,NT-proBNP和液體過載之間的相互作用可能與不良臨床預後相關。我們展示了NT-proBNP和液體過載與不良臨床結果的協同關聯。NT-proBNP和液體狀態可以提供更大的預測CKD人群不良臨床結果的活性。
此外,基線腎功能和蛋白尿是CKD患者不良臨床結果的傳統預測因素。液體狀態和血漿NT-proBNP隨著腎功能的下降和蛋白尿的增加而逐漸增加[13, 35]。基於這種密切相關,我們在分析模型中調整了基線腎功能和蛋白尿的嚴重程度,液體狀態和NT-proBNP可以預測疾病進展。此外,在調整了眾所周知的不良臨床結果風險因素,如年齡、性別、潛在心血管疾病和糖尿病後,同時有高血漿NT-proBNP和液體過載的CKD患者仍然增加了開始透析、MACEs或所有原因死亡率的風險。NT-proBNP和液體狀態可以用於臨床CKD實踐中監測心腎軸。
NT-proBNP被認為是心力衰竭或透析與否的CKD患者的診斷和預後活性的工具[36–39]。此外,許多研究報告NT-proBNP可以用來監測心力衰竭的效率[40, 41]。NT-proBNP引導的管理策略可以降低心力衰竭患者的死亡率[40]。此外,BNP還具有評估β-阻滯劑對透析患者左心室舒張功能影響的臨床應用[42]。由於NT-proBNP與液體狀態密切相關,NT-proBNP可能幫助臨床醫生評估當前的液體狀態以及利尿劑使用對液體過載的影響。液體狀態可能通過NT-proBNP驅動的管理策略進行控制,進一步改善透析患者的心血管負擔。同樣,通過BCM評估的液體狀態已被報導有助於血透患者左心室質量指數和動脈僵硬度的回歸以及血壓的降低[43]。然而,NT-proBNP或BCM引導的管理策略對非透析CKD患者不良臨床結果的影響仍待確定。需要進一步研究來確定NT-proBNP和BCM驅動干預對心血管後果、所有原因死亡率和腎功能惡化的影響。
NT-proBNP和液體過載被認為是MACEs和所有原因死亡率的生物標誌物[14, 44, 45]。本研究也顯示了一致的結果,但我們沒有發現NT-proBNP和液體過載與MACEs或所有原因死亡率有顯著的協同關聯。本研究隊列和事件數量相對較小是統計功率降低的原因之一。除了NT-proBNP和液體狀態外,不確定的機制可能參與增加CKD患者MACEs和所有原因死亡率的風險。此外,本研究也有一些限制。液體狀態、NT-proBNP和利尿劑使用在入組時只測量一次。無法估計隨時間變化的液體狀態和NT-proBNP與臨床結果的關聯。此外,研究中未檢查或記錄尿鈉和鈉攝入量,而正鈉平衡可能影響液體狀態、血管壓力和NT-proBNP水平[44]。鈉保留對液體狀態和臨床結果的影響可能被低估。
結論
我們的研究表明,在第4-5期CKD患者中,液體過載和NT-proBNP與開始透析有協同關聯。同時有液體過載和高循環NT-proBNP水平的患者比那些僅有液體過載或高循環NT-proBNP水平的患者,面臨更大的MACEs或所有原因死亡率風險。在CKD晚期的臨床護理中,應考慮NT-proBNP和液體狀態在不良結果中的相互作用,並可以更精確地用於預測臨床結果。
參考文獻
- 1.Takami Y, Horio T, Iwashima Y, Takiuchi S, Kamide K, Yoshihara F, et al. Diagnostic and prognostic value of plasma brain natriuretic peptide in non-dialysis-dependent CRF. Am J Kidney Dis. 2004; 44(3): 420–428. pmid:15332214
- 2.Panteghini M, Clerico A. Understanding the clinical biochemistry of N-terminal pro-B-type natriuretic peptide: The prerequisite for its optimal clinical use. Clin Lab. 2004; 50(5–6): 325–331. pmid:15209441
- 3.Kamano C, Osawa H, Hashimoto K, Nishimura S, Saito SK, Kashiwagi T, et al. N-Terminal pro-brain natriuretic peptide as a predictor of heart failure with preserved ejection fraction in hemodialysis patients without fluid overload. Blood Purif. 2012; 33(1–3): 37–43. pmid:22143056
- 4.Sudoh T, Kangawa K, Minamino N, Matsuo H. A new natriuretic peptide in porcine brain. Nature. 1988; 332(6159): 78–81. pmid:2964562
- 5.Khan I, AFink J, Nass C, Chen H, Christenson R, deFilippi CR. N-terminal pro-B-type natriuretic peptide and B-type natriuretic peptide for identifying coronary artery disease and left ventricular hypertrophy in ambulatory chronic kidney disease patients. Am J Cardiol. 2006; 97(10): 1530–1534. pmid:16679099
- 6.Wang AY, Lam CW, Yu CM, Wang M, Chan IH, Zhang Y. N-terminal pro-brain natriuretic peptide: an independent risk predictor of cardiovascular congestion, mortality, and adverse cardiovascular outcomes in chronic peritoneal dialysis patients. J Am Soc Nephrol. 2007; 18(1): 321–330. pmid:17167121
- 7.Paniagua R, Ventura MD, Avila-Díaz M, Hinojosa-Heredia H, Méndez-Durán A, Cueto-Manzano A, et al. NT-proBNP, fluid volume overload and dialysis modality are independent predictors of mortality in ESRD patients. Nephrol Dial Transplant. 2010; 25(2): 551–557. pmid:19679559
- 8.Roberts MA, Hare DL, Sikaris K, Ierino FL. Temporal trajectory of B-type natriuretic peptide in patients with CKD stages 3 and 4, dialysis, and kidney transplant. Clin J Am Soc Nephrol. 2014; 9(6): 1024–1032. pmid:24721887
- 9.Kim SE, Park S, Kim JK, Kim SG, Kim HJ, Song YR. B-type natriuretic peptide predicts an ischemic etiology of acute heart failure in patients with stage 4–5 chronic kidney disease. Clin Biochem. 2014; 47(6): 344–348. pmid:24486650
- 10.Fu S, Luo L, Ye P, Yi S, Liu Y, Zhu B, et al. The ability of NT-proBNP to detect chronic heart failure and predict all-cause mortality is higher in elderly Chinese coronary artery disease patients with chronic kidney disease. Clin Interv Aging. 2013; 8: 409–417. pmid:23723693
- 11.Spanaus KS, Kronenberg F, Ritz E, Schlapbach R, Fliser D, Hersberger M, et al. B-type natriuretic peptide concentrations predict the progression of nondiabetic chronic kidney disease: the Mild-to-Moderate Kidney Disease Study. Clin Chem. 2007; 53(7): 1264–1272. pmid:17478561
- 12.Sundqvist S, Larson T, Cauliez B, Bauer F, Dumont A, Le Roy F, et al. Clinical Value of Natriuretic Peptides in Predicting Time to Dialysis in Stage 4 and 5 Chronic Kidney Disease Patients. PLoS One. 2016;11(8): e0159914. pmid:27548064
- 13.Tsai YC, Tsai JC, Chen SC, Chiu YW, Hwang SJ, Hung CC, et al. Association of fluid overload with kidney disease progression in advanced CKD: a prospective cohort study. Am J Kidney Dis. 2014; 63(1): 68–75. pmid:23896483
- 14.Tsai YC, Chiu YW, Tsai JC, Kuo HT, Hung CC, Hwang SJ, et al. Association of fluid overload with cardiovascular morbidity and all-cause mortality in stages 4 and 5 CKD. Clin J Am Soc Nephrol. 2015; 10(1): 39–46. pmid:25512646
- 15.Lee SW, Song JH, Kim GA, Lim HJ, Kim MJ. Plasma brain natriuretic peptide concentration on assessment of hydration status in hemodialysis patient. Am J Kidney Dis. 2003; 41(6): 1257–1266. pmid:12776279
- 16.Ohashi Y, Saito A, Yamazaki K, Tai R, Matsukiyo T, Aikawa A, et al. Brain Natriuretic Peptide and Body Fluid Composition in Patients with Chronic Kidney Disease: A Cross-Sectional Study to Evaluate the Relationship between Volume Overload and Malnutrition. Cardiorenal Med. 2016; 6(4): 337–346. pmid:27648015
- 17.Levey AS, Bosch JP, Lewis JB, Greene T, Rogers N, Roth D, et al. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group. Ann Inter Med. 1999; 130(6): 461–470.
- 18.Moissl UM, Wabel P, Chamney PW, Bosaeus I, Levin NW, Bosy-Westphal A, et al. Body fluid volume determination via body composition spectroscopy in health and disease. Physiol Meas. 2006; 27(9): 921–933. pmid:16868355
- 19.Chamney PW, Wabel P, Moissl UM, Müller MJ, Bosy-Westphal A, Korth O, et al. A whole-body model to distinguish excess fluid from the hydration of major body tissues. Am J Clin Nutr. 2007; 85(1): 80–89. pmid:17209181
- 20.Hung SC, Kuo KL, Peng CH, Wu CH, Lien YC, Wang YC, et al. Volume overload correlates with cardiovascular risk factors in patients with chronic kidney disease. Kidney Int. 2014; 85(3): 703–709. pmid:24025647
- 21.Wizemann V, Rode C, Wabel P. Whole-body spectroscopy (BCM) in the assessment of normovolemia in hemodialysis patients. Contrib Nephrol. 2008; 161: 115–118. pmid:18451666
- 22.Crepaldi C, Soni S, Chionh CY, Wabel P, Cruz DN, Ronco C, et al. Application of body composition monitoring to peritoneal dialysis patients. Contrib Nephrol. 2009; 163: 1–6. pmid:19494588
- 23.Ryan TD, Rothstein EC, Aban I, Tallaj JA, Husain A, Lucchesi PA, et al. Left ventricular eccentric remodeling and matrix loss are mediated by bradykinin and precede cardiomyocyte elongation in rats with volume overload. J Am Coll Cardiol. 2007; 49(7): 811–821. pmid:17306712
- 24.Grossman W, Jones D, McLaurin LP. Wall stress and patterns of hypertrophy in the human left ventricle. J Clin Invest. 1975; 56(1): 56–64. pmid:124746
- 25.Goldfarb-Rumyantzev AS, Chelamcharla M, Bray BE, Leypoldt JK, Lavasani I, Nelson N, et al. Volume indicators and left ventricular mass during aggressive volume management in patients on thrice weekly haemodialysis. Nephron Clin Pract. 2009; 113(4): 270–280.
- 26.Booth J, Pinney J, Davenport A. N-terminal proBNP—marker of cardiac dysfunction, fluid overload, or malnutrition in hemodialysis patients? Clin J Am Soc Nephrol. 2010; 5(6): 1036–1040. pmid:20507952
- 27.Takase H, Dohi Y.Kidney function crucially affects B-type natriuretic peptide (BNP), N-terminal proBNP and their relationship. Eur J Clin Invest. 2014; 44 (3):303–308. pmid:24372567
- 28.Ikonomidis I, Tzortzis S, Tsantes A, Ntai K, Triantafyllidi H, Trivilou P, et al. The interplay between renin-angiotensin system activation, abnormal myocardial deformation and neurohumoral activation in hypertensive heart disease: a speckle tracking echocardiography study. Int J Cardiovasc Imaging. 2017; 33(3): 323–329. pmid:27787699
- 29.Shaw SM, Fildes JE, Puchałka CM, Basith M, Yonan N, Williams SG. BNP directly immunoregulates the innate immune system of cardiac transplant recipients in vitro. Transpl Immunol. 2009; 20(3): 199–202. pmid:18812222
- 30.Muñoz-Durango N, Fuentes CA, Castillo AE, González-Gómez LM, Vecchiola A, Fardella CE, et al. Role of the Renin-Angiotensin-Aldosterone System beyond Blood Pressure Regulation: Molecular and Cellular Mechanisms Involved in End-Organ Damage during Arterial Hypertension. Int J Mol Sci. 2016; 17(7): E797. pmid:27347925
- 31.Meirovich YF, Veinot JP, de Bold ML, Haddad H, Davies RA, Masters RG, et al. Relationship between natriuretic peptides and inflammation: proteomic evidence obtained during acute cellular cardiac allograft rejection in humans. J Heart Lung Transplant. 2008; 27(1): 31–37. pmid:18187084
- 32.Provan SA, Angel K, Odegard S, Mowinckel P, Atar D, Kvien TK. The association between disease activity and NT-proBNP in 238 patients with rheumatoid arthritis: a 10 year longitudinal study. Arthritis Res Ther. 2008; 10(3): R70. pmid:18573197
- 33.Bradham WS, Ormseth MJ, Oeser A, et al. Insulin resistance is associated with increased concentrations of NT-proBNP in rheumatoid arthritis: IL-6 as a potential mediator. Inflammation. 2014; 37(3): 801–808. pmid:24402421
- 34.McIntyre CW, Harrison LE, Eldehni MT, Jefferies HJ, Szeto CC, John SG, et al. Circulating endotoxemia: a novel factor in systemic inflammation and cardiovascular disease in chronic kidney disease. Clin J Am Soc Nephrol. 2011; 6(1): 133–141. pmid:20876680
- 35.Desai AS, Toto R, Jarolim P, Uno H, Eckardt KU, Kewalramani R, et al. Association between cardiac biomarkers and the development of ESRD in patients with type 2 diabetes mellitus, anemia, and CKD. Am J Kidney Dis. 2011; 58(5): 717–728. pmid:21820220
- 36.Worster A, Balion CM, Hill SA, Santaguida P, Ismaila A, McKelvie R, et al. Diagnostic accuracy of BNP and NT-proBNP in patients presenting to acute care settings with dyspnea: a systematic review. Clin Biochem. 2008; 41(4–5): 250–259. pmid:17915204
- 37.Wang AY, Lai KN. Use of cardiac biomarkers in end-stage renal disease. J Am Soc Nephrol. 2008; 19(9): 1643–1652. pmid:18322158
- 38.Wang AY. Clinical utility of natriuretic peptides in dialysis patients. Semin Dial. 2012; 25(3): 326–33. pmid:22607214
- 39.Yasuda K, Kimura T, Sasaki K, Obi Y, Iio K, Yamato M, et al. Plasma B-type natriuretic peptide level predicts kidney prognosis in patients with predialysis chronic kidney disease. Nephrol Dial Transplant. 2012; 27(10): 3885–3891. pmid:23114906
- 40.Felker GM, Hasselblad V, Hernandez AF, O’Connor CM. Biomarker guided therapy in chronic heart failure: A meta-analysis of randomized controlled trials. Am Heart J. 2009; 158(3): 422–430. pmid:19699866
- 41.Eurlings LW, van Pol PE, Kok WE, van Wijk S, Lodewijks-van der Bolt C, Balk AH,et al. Management of chronic heart failure guided by individual N-terminal pro-B-type natriuretic peptide targets: results of the PRIMA (Can PRo-brain-natriuretic peptide guided therapy of chronic heart failure IMprove heart fAilure morbidity and mortality?) study. J Am Coll Cardiol. 2010; 56(25): 2090–100 pmid:21144969
- 42.Kojima M, Sato K, Kimura G, Ueda R, Dohi Y. Carvedilol reduces elevated B-type natriuretic peptide in dialyzed patients without heart failure: Cardioprotective effect of the beta-blocker. J Cardiovasc Pharmacol. 2007; 49(4): 191–196. pmid:17438403
- 43.Hur E, Usta M, Toz H, Asci G, Wabel P, Kahvecioglu S, et al. Effect of fluid management guided by bioimpedance spectroscopy on cardiovascular parameters in hemodialysis patients: a randomized controlled trial. Am J Kidney Dis. 2013; 61(6): 957–965. pmid:23415416
- 44.Cheng YJ, Yao FJ, Liu LJ, Tang K, Lin XX, Li WJ, et al. B-type natriuretic peptide and prognosis of end-stage renal disease: a meta-analysis. PLoS One. 2013; 8(11): e7930
- 45.Vickery S, Price CP, John RI, Abbas NA, Webb MC, Kempson ME, et al. B-type natriuretic peptide (BNP) and amino-terminal proBNP in patients with CKD: relationship to renal function and left ventricular hypertrophy. Am J Kidney Dis. 2005; 46(4): 610–620 pmid:16183415



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย