本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
在越南進行的一項研究顯示,針對非嚴重急性呼吸道感染的患者進行C-反應蛋白(CRP)快速測試,可以有效地減少抗生素的使用。這項多中心隨機對照試驗共納入2037名患者,結果顯示CRP測試組中有64%的患者在14天內使用了抗生素,而對照組則有78%。這項研究證明了在低資源環境中,通過CRP測試來指導治療,可以安全地減少不必要的抗生素使用。
點護理C-反應蛋白檢測以減少越南基層保健中不嚴重急性呼吸道感染不當使用抗生素的隨機對照試驗
Point-of-care C-reactive protein testing to reduce inappropriate use of antibiotics for non-severe acute respiratory infections in Vietnamese primary health care: a randomised controlled trial
Do NT, Ta NT, Tran NT, Than HM, Vu BT, Hoang LB, van Doorn HR, Vu DT, Cals JW, Chandna A, Lubell Y, Nadjm B, Thwaites G, Wolbers M, Nguyen KV, Wertheim HF. Point-of-care C-reactive protein testing to reduce inappropriate use of antibiotics for non-severe acute respiratory infections in Vietnamese primary health care: a randomised controlled trial. Lancet Glob Health. 2016 Sep;4(9):e633-41. doi: 10.1016/S2214-109X(16)30142-5. Epub 2016 Aug 3. Erratum in: Lancet Glob Health. 2017 Jan;5(1):e39. PMID: 27495137; PMCID: PMC4985565.
https://www.thelancet.com/journals/langlo/article/PIIS2214-109X(16)30142-5/fulltext
Summary
Background
Inappropriate antibiotic use for acute respiratory tract infections is common in primary health care, but distinguishing serious from self-limiting infections is difficult, particularly in low-resource settings. We assessed whether C-reactive protein point-of-care testing can safely reduce antibiotic use in patients with non-severe acute respiratory tract infections in Vietnam.
Method
We did a multicentre open-label randomised controlled trial in ten primary health-care centres in northern Vietnam. Patients aged 1–65 years with at least one focal and one systemic symptom of acute respiratory tract infection were assigned 1:1 to receive either C-reactive protein point-of-care testing or routine care, following which antibiotic prescribing decisions were made. Patients with severe acute respiratory tract infection were excluded. Enrolled patients were reassessed on day 3, 4, or 5, and on day 14 a structured telephone interview was done blind to the intervention. Randomised assignments were concealed from prescribers and patients but not masked as the test result was used to assist treatment decisions. The primary outcome was antibiotic use within 14 days of follow-up. All analyses were prespecified in the protocol and the statistical analysis plan. All analyses were done on the intention-to-treat population and the analysis of the primary endpoint was repeated in the per-protocol population. This trial is registered under number NCT01918579.
Findings
Between March 17, 2014, and July 3, 2015, 2037 patients (1028 children and 1009 adults) were enrolled and randomised. One adult patient withdrew immediately after randomisation. 1017 patients were assigned to receive C-reactive protein point-of-care testing, and 1019 patients were assigned to receive routine care. 115 patients in the C-reactive protein point-of-care group and 72 patients in the routine care group were excluded in the intention-to-treat analysis due to missing primary endpoint. The number of patients who used antibiotics within 14 days was 581 (64%) of 902 patients in the C-reactive protein group versus 738 (78%) of 947 patients in the control group (odds ratio [OR] 0·49, 95% CI 0·40–0·61; p<0·0001). Highly significant differences were seen in both children and adults, with substantial heterogeneity of the intervention effect across the 10 sites (I2=84%, 95% CI 66–96). 140 patients in the C-reactive protein group and 137 patients in the routine care group missed the urine test on day 3, 4, or 5. Antibiotic activity in urine on day 3, 4, or 5 was found in 267 (30%) of 877 patients in the C-reactive protein group versus 314 (36%) of 882 patients in the routine treatment group (OR 0·78, 95% CI 0·63–0·95; p=0·015). Time to resolution of symptoms was similar in both groups. Adverse events were rare, with no deaths and a total of 14 hospital admissions (six in the C-reactive protein group and eight in the control group).
Interpretation
C-reactive protein point-of-care testing reduced antibiotic use for non-severe acute respiratory tract infection without compromising patients’ recovery in primary health care in Vietnam. Health-care providers might have become familiar with the clinical picture of low C-reactive protein, leading to reduction in antibiotic prescribing in both groups, but this would have led to a reduction in observed effect, rather than overestimation. Qualitative analysis is needed to address differences in context in order to implement this strategy to improve rational antibiotic use for patients with acute respiratory infection in low-income and middle-income countries.
Funding
Wellcome Trust, UK, and Global Antibiotic Resistance Partnership, USA.
摘要
背景
在基層保健中,不當使用抗生素治療急性呼吸道感染很常見,但區分嚴重和自限性感染尤其在資源有限的環境中很困難。我們評估了C-反應蛋白點護理測試是否可以安全地減少越南非嚴重急性呼吸道感染患者的抗生素使用。
方法
我們在越南北部的十個基層保健中心進行了一項多中心開放標籤隨機對照試驗。年齡在1-65歲之間,有至少一個局部和一個全身症狀的急性呼吸道感染患者被1:1分配接受C-反應蛋白點護理測試或常規護理,之後作出抗生素處方決定。嚴重急性呼吸道感染患者被排除在外。入組患者在第3、4或5天被重新評估,並在第14天進行了對干預措施不知情的結構化電話訪談。隨機分配對處方者和患者保密,但由於測試結果用於協助治療決策,因此未進行蒙蔽。主要結果是隨訪14天內的抗生素使用。所有分析都在協議和統計分析計劃中預先規定。所有分析都在意圖治療人群中進行,並在按原計劃人群中重複主要終點的分析。本試驗註冊號為NCT01918579。
結果
在2014年3月17日至2015年7月3日之間,共有2037名患者(1028名兒童和1009名成人)入組並被隨機分配。一名成人患者在隨機分配後立即退出。1017名患者被分配接受C-反應蛋白點護理測試,1019名患者被分配接受常規護理。在意圖治療分析中,由於缺少主要終點,C-反應蛋白點護理組中有115名患者和常規護理組中有72名患者被排除。隨訪14天內使用抗生素的患者數為C-反應蛋白組中的902名患者中的581名(64%)與對照組中的947名患者中的738名(78%)(勝算比[OR] 0·49,95% CI 0·40–0·61;p<0·0001)。兒童和成人中都觀察到高度顯著的差異,且10個地點間干預效果的異質性顯著(I2=84%,95% CI 66–96)。在C-反應蛋白組中有140名患者和在常規護理組中有137名患者在第3、4或5天錯過了尿液測試。在第3、4或5天,C-反應蛋白組中的877名患者中有267名(30%)與常規治療組中的882名患者中有314名(36%)的尿液中發現抗生素活性(OR 0·78,95% CI 0·63–0·95;p=0·015)。兩組的症狀消失時間相似。不良事件罕見,沒有死亡,共有14次住院(C-反應蛋白組6次,對照組8次)。
解釋
C-反應蛋白點護理測試減少了越南基層保健中非嚴重急性呼吸道感染的抗生素使用,且不影響患者的康復。醫療保健提供者可能已經熟悉了低C-反應蛋白的臨床圖像,從而導致兩組患者抗生素處方的減少,但這可能導致觀察效果的減少,而不是高估。需要進行質性分析來解決實施這一策略以改善低收入和中等收入國家急性呼吸感染患者合理使用抗生素的背景差異。
資助
英國Wellcome Trust和美國全球抗生素抗性夥伴關係。
引言
在全球範圍內,細菌病原體對抗生素的耐藥性日益增強。這一問題在發展中國家尤為嚴重,因為這些國家的傳染病負擔高,而更新、更昂貴的抗生素的可獲得性低。1
越南已經有很多抗生素耐藥性。越南鏈球菌肺炎的青黴素耐藥率為71%,紅黴素耐藥率為92%,是亞洲最高的。2卡巴培南在院內感染中對綠膿桿菌(25%)和鮑曼不動桿菌(40%)的耐藥性高。3耐藥性的發展是多因素的,但主要驅動因素可能是人類中頻繁且常常不慎用藥,以及在農業和水產養殖中的廣泛使用。4在越南,大多數抗生素在私人藥房購買,無需處方(城市地區為88%,農村地區為91%),主要用於治療咳嗽。5
研究背景
此前的證據
在2014年的一項科克蘭回顧中,Aabenhus和Jensen搜索了包括CENTRAL、MEDLINE、Embase、CINAHL、Web of Science和LILACS在內的幾個電子數據庫,直到2014年1月,並確定了六項試驗(其中三項是個體隨機對照試驗[RCT],三項是群體RCT)。他們發現C-反應蛋白(CRP)檢測的群體RCT主要在減少抗生素處方方面有效。我們搜索了MEDLINE和科克蘭圖書館,以“抗生素”、“基層保健”、“干預”、“呼吸道感染”、“C反應蛋白”和“點護理”組合發布的文章。除了科克蘭回顧中已包含的試驗外,我們沒有發現最近的試驗。
本研究的新增價值
之前的所有個體RCT和群體RCT都是在歐洲國家進行的。在低收入或中等收入國家的基層保健設置中,或針對兒童,尚未進行過類似試驗。在越南這個中低收入國家的環境中,我們評估了一項負擔得起且實用的C-反應蛋白點護理測試是否可以安全地幫助減少成人和兒童非嚴重急性呼吸道感染的抗生素使用。
所有可用證據的含義
我們的發現表明,這項干預措施可以應用於低收入和中等收入國家資源有限的環境中,以改善兒童和成人非嚴重急性呼吸道感染的合理抗生素使用,而不影響患者的康復和滿意度。十個衛生保健站之間的顯著異質性表明,定期審查任何干預措施並根據具體的本地情況進行調整的重要性。
在社區設置中,大多數不適當的抗生素處方或配送是針對急性呼吸道感染的,這些感染通常是自限性的,在基層衛生中心或藥房中進行。6、7 儘管有關越南基層保健中處方驅動因素的數據稀少,但確定的主要原因之一是診斷上的不確定性。8 區分嚴重和自限性急性呼吸道感染具有挑戰性,通常僅依賴於仔細的病史和檢查。錯過嚴重感染的擔憂可能會促使抗生素處方。在低收入環境中,由於衛生基礎設施較不發達,醫生可能還擔心患者感知或實際上無法在病情惡化時獲得醫療服務。這些因素可能促使抗生素的過度使用。因此,實施一項快速、負擔得起的點護理測試以幫助診斷和管理並安全地減少抗生素使用是一個吸引人的前景。
C-反應蛋白(CRP)是存在炎症過程的生物標記。9、10 在高收入國家的幾項研究中已經表明,使用點護理CRP測試的基層衛生保健提供者在患有咳嗽的患者中處方較少抗生素,而不會對患者康復產生不利影響。11、12 在低收入和中等收入國家的基層保健設置中尚未進行過此類試驗,在這些國家中無限制的抗微生物藥物訪問和抗生素耐藥性最高,不同的社會和臨床因素可能影響其影響。鑑於越南基層護理中出現的大量自限性急性呼吸道感染,即使是適度減少也將大大減少抗生素處方的絕對數量,從而減少細菌耐藥性的主要驅動因素之一。兒童特別是經常被不適當地處方抗生素用於急性呼吸道感染,任何研究也應該解決這一重要群體。7
本研究旨在評估CRP點護理測試對越南基層保健中心出現非嚴重急性呼吸道感染的兒童和成人減少不適當抗生素使用的效果。
方法
研究設計
我們在越南北部選定的十個基層保健中心進行了一項開放標籤隨機對照試驗。出現非嚴重急性呼吸道感染的患者被隨機分配到CRP點護理測試(干預)或常規護理(對照)。隨機分配對處方者和患者保密,但由於測試結果用於協助治療決策,因此未進行蒙蔽。
越南的公共衛生服務從國家分散到省、區和公社級別。基層保健(在區和公社級別)提供常規和緊急醫療服務以及轉診到醫院。我們的目標是納入十個城市和農村基層保健中心,每天至少有五例急性呼吸道感染病例,位於河內60公里半徑內。對於城市中心,我們邀請所有20個現有的區域綜合診所參與;三個未回應,兩個拒絕參與,六個未達到病例負荷標準。因此,我們選擇了剩下的九個城市地點實施試驗。對於農村地點,我們選擇了一家地區綜合醫院(Ba Vi醫院)的門診部,位於河內以西60公里。農村河內其他非醫院診所的病例負荷太低。
患者
年齡在1-65歲之間,前往這些基層保健中心就診,並被治療醫生懷疑有非嚴重急性呼吸道感染,至少有一個局部和一個全身徵狀或症狀的患者,有資格參加本研究。局部徵狀和症狀包括咳嗽、鼻炎、咽炎、呼吸急促、喘鳴、胸痛和聽診異常。全身徵狀和症狀包括發熱、出汗、頭痛、肌肉痛和感覺一般不適。兒童定義為1-15歲的患者。有嚴重急性呼吸道感染徵狀的患者被排除。成人和兒童的詳細一般和特定納入和排除標準列在附錄中。
研究醫生或研究護士向患者或法定監護人解釋了試驗,包括風險和益處。在口頭同意後,獲得書面知情同意。獲得同意後,為每位患者填寫一份病例報告表,包含與研究變量相關的所有信息。所有患者接受常規病史和檢查,包括病史、精神狀態(格拉斯哥昏迷量表)、生命體徵(血壓、脈搏、呼吸率)和體溫。進一步檢查由治療醫生酌情決定。
隨機分配和蒙蔽
符合條件的患者被1:1隨機分配到CRP點護理測試或對照組(常規護理),使用個體隨機分配方法,按衛生站和年齡類別(兒童對成人)進行分層。隨機分配名單是通過電腦生成的,使用長度為四(概率為0.75)和六(概率為0.25)的變量塊。分配是通過不透明密封信封隱藏的,13在嚴格按時間順序進行隨機分配時打開。為保護患者身份,每位參與者分配了一個研究識別號碼,用於所有研究材料。患者和研究者對治療分配並未蒙蔽,除了進行2週電話訪談的執行者,他們對受訪者接受的干預措施是盲目的。
程序
對於干預組的患者,進行了指尖采血以獲取毛細血管血液,並在入組時(第0天)和第3、4或5天使用NycoCard分析儀(CRP單一測試套件與NycoCard II讀卡器,Alere Technologies,挪威)進行分析。對照組患者按照常規實踐和當地治療指南在入組和第二次訪問時進行治療。所有患者在最初的衛生診所訪問後2週進行結構化電話訪談隨訪。
醫生被培訓使用特定的CRP截止值,這些基於之前的研究並為兒童使用進行了調整。12、14、15、16我們進行了中心初始培訓研討會,隨後在十個衛生中心進行現場實施訪問期間由研究團隊進行了進一步培訓。培訓遵循了在荷蘭馬斯特里赫特進行類似研究的模型,並根據越南情況進行了語境化,並用越南語進行。15、17培訓材料既有口頭的,也有書面的,包括口頭演講和為醫生和衛生中心保留以供將來參考的書面資料。研究期間,衛生中心和醫生被給予一個電話號碼,以便在有任何疑問時聯繫。為特定年齡組推薦的截止值提供了覆膜海報和桌面提醒。
推薦不開抗生素的截止值是6-65歲患者的CRP為20 mg/L或以下,1-5歲患者的CRP為10 mg/L或以下。醫生被建議成人CRP在100 mg/L或以上和兒童CRP在50 mg/L或以上的情況下,通常應該接受抗生素,並應考慮轉診醫院。在這些閾值之間沒有具體建議,並建議臨床醫生使用其臨床判斷力。
2週後,通過電話對入組患者進行訪談,由對干預措施不知情的訪談者進行,以評估他們是否去過任何衛生診所,是否服用過同一急性呼吸道感染的任何藥物,藥物來源,任何嚴重不良事件(例如,住院入院),急性呼吸道感染症狀的解決時間,以及對提供的護理的滿意度。第0天給患者提供了症狀日記作為記憶幫助。
醫生要求患者在第3、4或5天返回診所。在第二次訪問(第3、4或5天)時,由原診療醫生收集入組患者的尿液樣本(除了失訪的患者、在訪問時不能按命令排尿的幼兒和月經期的女性),用於檢測抗微生物藥物的存在。在Müller Hinton瓊脂(Oxoid)中使用受試者的尿液培養對靈敏度全面的ATCC 25923金黃色葡萄球菌和ATCC 25922大腸埃希菌。18、19我們使用了在尿液收集時正在接受抗生素治療的患者的陽性對照。來自健康人的陰性對照尿液是在收集尿液前至少3天未服用任何藥物。陽性結果是兩個或兩個以上瓊脂板上的任何一種ATCC細菌菌株的清晰區域直徑大於10毫米。據報導,這項測試的敏感性為97.37%,特異性約為98.85%。19
結果
主要終點是入組後2週內接受任何抗生素的患者數量。抗生素使用被定義為至少滿足以下一項:入組時(第0天)抗生素處方,隨訪訪問時(第3、4或5天)報告的抗生素使用,第二次訪問時(第3、4或5天)的抗生素處方,尿液中的抗微生物活性,或隨訪訪談時(第14天)報告的抗生素使用。如果至少滿足其中一項條件,則將參與者分類為抗生素使用陽性;如果所有五項標準均記錄為否定,則分類為陰性;如果所有報告的標準均為否定,但至少有一項標準數據缺失,則分類為缺失。
次要終點是尿液中的抗微生物活性(第3、4或5天),入組時立即開出的抗生素處方比例,未立即開處方的患者中的任何抗生素使用情況(隨後的抗生素使用或干預失敗),以及第二次訪問時未立即開處方患者的處方(基於隨訪評估的臨床管理變更)。額外的次要終點是入組時或第4天未開處方而服用的任何抗生素的來源(自行用藥、藥物銷售者、醫生或其他),再次諮詢的頻率,嚴重不良事件(住院或死亡),症狀解決時間,以及參與試驗第14天報告的患者滿意度(在0至10的量表上測量)。滿意度得分5分或以上者被認為是滿意的。
統計分析
我們預期CRP指導將至少減少20%的急性呼吸道感染抗生素處方:從80%7降至60%。然而,通過試驗本身提高對問題的認識,可能會降低抗生素處方,從而減少CRP測試的效果。因此,試驗的目的是檢測抗生素處方率從70%降至60%,這是基於越南社區中抗生素使用的數據。7為了檢測這樣的差異,以90%的力量和兩側5%的顯著性,每個臂需要477名患者。為了分別分析成人和兒童,目標樣本量設定為2000名患者(兒童和成人各佔50%)。
統計分析在協議和統計分析計劃中預先定義。所有分析的主要人群是意圖治療人群,包括所有隨機分配的患者,除了那些立即退出的患者,並根據治療臂進行分析。缺少結果的患者被排除在分析之外。然而,對於主要結果,我們還進行了基於對那些患者的結果進行多重插補的另一種替代分析。此外,主要終點的分析在按原計劃人群中重複進行,該人群僅包括所有上述提到的主要終點組件均非缺失的患者。
為了正式比較兩個治療組之間的綜合主要終點及其組成部分,我們使用了一個邏輯回歸模型,根據治療組和年齡階層(兒童對成人)作為固定效應,衛生保健中心作為隨機效應,從而考慮到中心內的聚集。由於我們在衛生保健中心之間看到主要終點的顯著異質性,我們決定事後使用森林圖可視化結果並進行標準隨機效應的meta分析。
症狀解決時間使用Kaplan-Meier曲線可視化,兩個治療組之間的正式比較基於Cox比例風險模型,治療分配和年齡階層作為固定效應,衛生保健中心作為高斯隨機效應(脆弱性)。所有數據衍生都是使用SAS版本9.2(SAS Institute Inc.,Cary,USA)完成的,統計分析是使用統計軟件R版本3.2.2(R統計計算基金會,維也納,奧地利)進行的。
試驗獲得了河內國家熱帶病醫院倫理委員會(39/IRB-NHTD)和牛津大學熱帶研究倫理委員會(OxTREC參考:176-12)的批准。也獲得了當地當局的許可。本試驗在ClinicalTrials.gov註冊,號碼為NCT01918579。
資金來源的作用
研究的資助者和Alere Technologies(提供試劑)在研究設計、數據收集、數據分析和解釋,或撰寫和提交研究論文方面均無角色。通訊作者可以完全訪問研究中的所有數據,並對發表論文的最終責任。
結果
患者從2014年3月17日至2015年7月3日被納入。在3532名篩查的患者中,有1258名未滿足納入標準,其中417名患者(33%)在就診時已經服用過抗生素,237名患者拒絕參加。共有2037名患者從10個中心(每個地點153-271名患者)被納入並隨機分配。一名患者在隨機分配後立即退出。1017名患者(510名兒童,507名成人)被隨機分配到CRP組,1019名患者(518名兒童,501名成人)被分配到對照組。CRP組的1017名患者中有115名(11%)和對照組的1019名患者中有72名(7%)沒有主要結果。按原計劃分析包含了CRP組的773名患者和對照組的761名患者(圖1)。
圖1 試驗概況入組時參與者的特徵在兩組之間相似,包括年齡、疾病持續時間、生命體徵和初診時的臨床症狀。2036名患者中有1224名(60%)是女性。初診時的症狀包括:咳嗽、喉嚨痛、鼻塞、發熱、呼吸困難和耳痛(表1)。
表1 基線特徵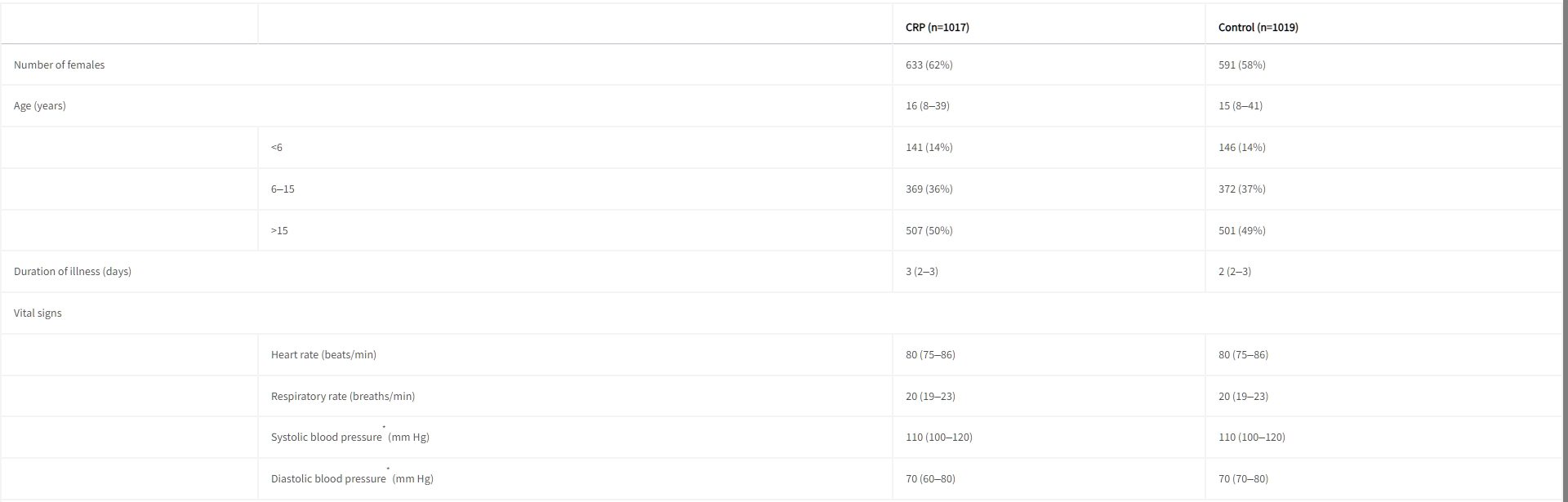
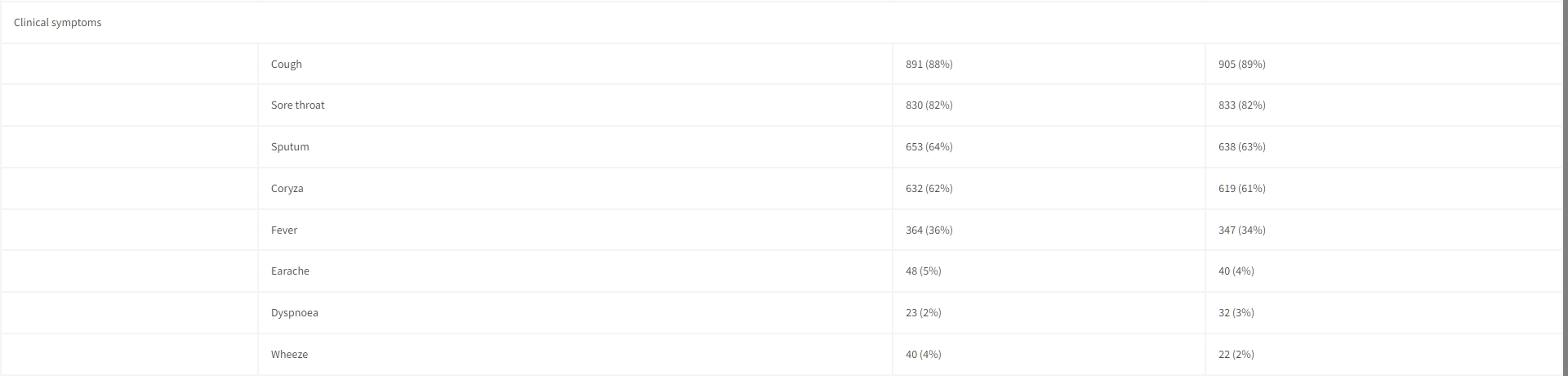
數據以中位數(IQR)或數字(%)表示。
血壓僅針對成年人報告。 年齡、性別和心率適用於所有患者,並且所有成年人都測量了血壓。 呼吸頻率對於四名(0.2%)患者不可用,對於13名(0.6%)患者的臨床症狀不可用。
在意圖治療分析中,CRP引導組中的902名患者中有581名(64%),而常規治療組中的947名患者中有738名(78%)在隨訪的14天內使用了抗生素(勝算比[OR] 0.49,95% CI 0.40–0.61; p<0.0001)。基於多重插值的意圖治療分析(0.50,0.41–0.61; p<0.0001)和議定書分析(0.51,0.41–0.63; p<0.0001)的相應效應大小相似,成年人和兒童均觀察到顯著的減少(表2)。各健康中心之間存在顯著的異質性(I2=84%,95% CI 66–96),因此隨機治療效應模型的匯總中位數治療效應估計值(OR 0.47)顯示了95% CI範圍更廣,為0.26–0.83(圖2)。
表2 隨訪的14天內接受任何抗生素的患者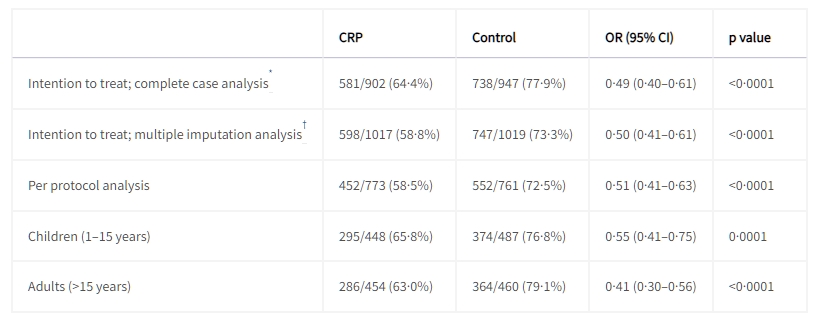
數據以事件次數/百分比(n%)表示,除非另有說明。OR(勝算比)為經過年齡組別和隨機站點效應調整的 logistic 回歸模型得出的結果。
隨機站點效應的方差估計為0·41,意味著內類相關為0·41 / (0·41 + π2) = 0.11。對於主要結果(經過年齡組別和站點效應調整)的附加二項回歸模型給出了調整後的絕對風險差異為-12·5%(95% CI -16·6 到 -8·6),p<0·0001。
† 基於20個填充數據集。報告的事件數和比例是所有填充數據集的平均值。
在意向分析中,常規組中立即處方抗生素的情況較高(1019名患者中的647名,佔63%),而CRP組中的情況較低(1017名患者中的441名,佔43%;OR 0·41,95% CI 0·34–0·49;p<0·0001)。這種差異在議定分析中也是顯著的(OR 0·46,95% CI 0·37–0·57;p<0·0001)。在常規護理組中,兒童和成人的就診時抗生素處方明顯更高(表3)。
表3 次要結果摘要(意向分析)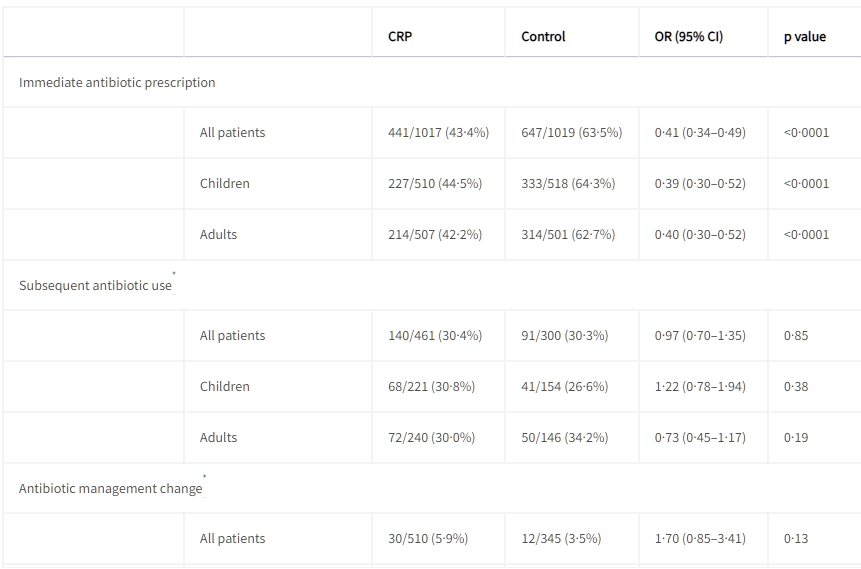
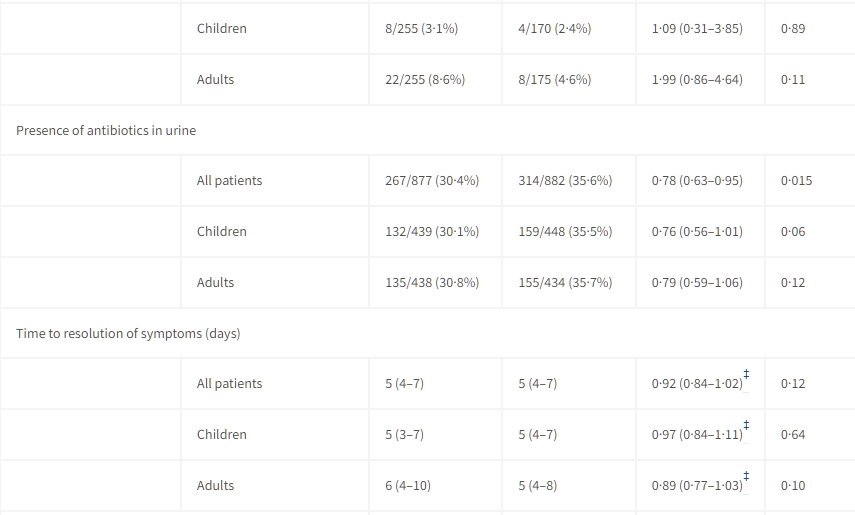
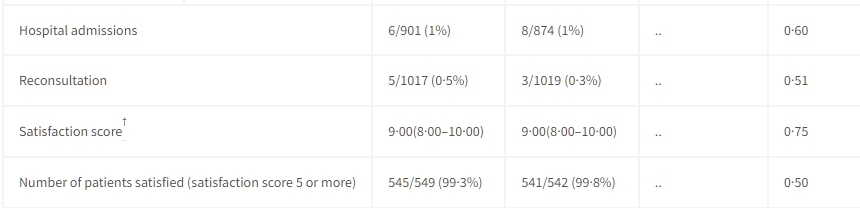
數據以事件次數/百分比(n%)或中位數(IQR)表示。OR(勝算比)來自於經過年齡組別和隨機站點效應調整的 logistic 回歸模型。比較基於 logistic 回歸、Cox 回歸、Fisher 精確檢驗(住院、再次諮詢和滿意的患者數)或Wilcoxon 秩和檢驗(滿意分數)。
隨後的抗生素使用和抗生素管理變更僅報告給未立即處方抗生素的患者,即它們指的是非隨機比較,因為分母人群取決於治療組。
† 滿意分數在0到10的評分表上進行測量,僅在C-反應蛋白組中的549名患者和對照組中的542名患者中提供。
‡ Hazard ratio 來自於經過年齡組別和隨機站點效應調整的 Cox 回歸模型。
在健康中心之間,立即使用抗生素的情況存在顯著的異質性(I2=94%,95% CI 87–98)(見附錄)。隨訪的前14天內,兩組患者中未立即處方抗生素的隨後使用(干預失敗)相似,CRP組中有461名患者中的140名(30%),常規護理組中有300名患者中的91名(30%)(OR 0·97,95% CI 0.7–1.35;p=0.85)。在兒童和成人中,相應的效應大小相似(見表3)。在使用抗生素但未經處方的165名患者中(常規護理組72名,CRP組93名),133例中記錄了抗生素的來源。最常見的來源是藥物銷售商指導的抗生素使用(66例),其次是醫生處方(39例)和自我用藥(27例),或其他來源(1例)。
第3天、第4天或第5天的尿樣中的抗菌活性在CRP組中明顯低於常規治療組。在意向分析人群中,CRP組中的877名患者中有267名(30%)患者檢測出抗菌活性,而常規治療組中的882名患者中有314名(36%)患者檢測出抗菌活性(OR 0·78,95% CI 0.63–0.95;p=0.015)(見表3)。在接受立即抗生素治療的953名患者中,有444名(47%)患者檢測出抗菌活性。記錄的先前抗生素使用與尿樣中抗菌活性的檢測之間存在中度一致性,κ=0.43(95% CI 0.39–0.47)。在未記錄先前抗生素使用的患者中,CRP組中有487名患者中的46名(9%)患者和對照組中的319名患者中的26名(8%)患者具有陽性尿檢結果。在記錄了先前抗生素使用的患者中,CRP組中的390名患者中有221名(57%)患者和常規護理組中的563名患者中的288名(51%)患者檢測出抗菌活性。在記錄了先前抗生素使用的患者中,陽性尿檢結果最少的是農村Ba Vi站的對照組,有71名患者中的23名(32%)具有陽性尿檢結果。在未接受立即抗生素處方的患者中,CRP組中的510名患者中有30名(6%)患者和意向分析中的常規組的345名患者中的12名(3%)患者在第3、4或第5天接受抗生素處方(抗生素管理變更)(OR 1.70,95% CI 0.85–3.41;p=0.13)(見表3)。
症狀解決的時間在兩組之間相似(見圖3),兩組的中位數持續時間均為5天(IQR 4–7)(風險比[HR] 0.92,95% CI 0.84–1.02)(見表3)。不良事件,定義為入院或入院和第14天之間的死亡,很少見,沒有死亡,14例入院(常規治療組8例,CRP組6例)。在1019名常規組患者中,有3名需要再次諮詢,而在1017名CRP組患者中有5名(見表3)。我們未檢測到隨機分組之間患者滿意度的差異(見表3)。
圖3 時間至症狀解決的Kaplan-Meier曲線,按治療組分類在即刻處方抗生素的患者中,1017例CRP測量中有758例(75%)小於10 mg/L,133例(13%)在11-20 mg/L,101例(10%)在21-50 mg/L,只有25例(2%)超過50 mg/L。對於6歲以下的兒童,當入學時CRP值為10 mg/L或以下時,有81名患者中的28名(35%)接受了即刻處方抗生素。在459名成年人中,當第0天的CRP值為20 mg/L或以下時,有171名患者中的37%接受了即刻處方抗生素(見附錄)。對干預算法的遵循在不同地點之間變化很大。對於6-65歲的患者,其第0天的CRP值為20 mg/L或以下,即刻處方抗生素的比率從75名患者中的3名(4%)(在Sai Dong站)到69名患者中的49名(71%)(在Dong Da站)不等。
討論
本研究顯示,在越南初級保健中心,CRP即時測試的可用性可以減少成人和兒童非嚴重急性呼吸道感染的不必要抗生素使用,而不會影響臨床康復或嚴重不良事件。我們的研究結果在我們使用的所有結果測量方面都是一致的:分發和處方數據、患者自報告以及尿液中經微生物學確認的抗生素存在。這個試驗是首個在資源有限的環境中研究CRP即時測試效應的試驗,並且CRP測試對兒童抗生素使用的影響在隨機對照試驗中以前從未評估過。
在我們的試驗中,CRP測試的整體絕對減少率為14%(78%比64%),其效果與荷蘭的報告相似,那裡的減少率為12%(65%比53%;風險比[RR] 0·81)20,並且高於挪威的報告,那裡觀察到不顯著的減少(RR 0·95,95% CI 0·76-1·18)。荷蘭和俄羅斯的叢集隨機對照試驗分別顯示了18%15和15%14的顯著減少。與以前的個體隨機對照試驗17,21,22相比,我們研究中即刻處方率的下降也更大,但低於叢集隨機對照試驗12,14,15。
CRP即時測試效果在不同地點之間存在顯著的異質性。一些地點可能並未遵循干預算法。為何醫師未遵循CRP算法的原因尚不清楚。對干預的全面定性評估已完成,將另行報告。值得注意的是,以前一項在歐洲國家進行的研究結果12表明,結合CRP測試和教育的干預對處方有最大的影響。
與以前的試驗結果一樣,引入CRP測試後未觀察到康復、嚴重不良事件和患者滿意度方面的差異,儘管鑒於所討論的良性臨床綜合症狀,不太可能有足夠的動力來檢測結果中的差異。一項試驗先前記錄了與CRP引導治療相關的住院增加。然而,這種不良事件很少見(總共4264名患者中的30例),應該權衡這種風險與大規模減少不適當抗生素使用的益處之間的利弊。在我們的研究中,這種不良事件也極為罕見,兩組之間似乎沒有明顯的差異。
儘管以前的大型試驗大多僅觀察處方數據或抗生素使用的自報告,但在這項研究中,尿液抗微生物活性測試提供了額外的信息。與即刻處方抗生素的比率相比(CRP組43%對常規組64%),尿液抗微生物活性的檢測率顯著較低:CRP組為36%,常規組為30%。記錄的抗生素使用和尿液抗微生物活性的檢測之間的一致性只有中度(κ=0·43)23,尿液中抗微生物活性的檢測在對照組中更低,在農村Ba Vi站的對照組中最低。這可能是由於患者在第3、4或第5天的第二次訪問之前停止使用抗生素,正如以前的一項研究報告,該研究報告了越南農村地區的兒童中有341名(42%)患者僅使用抗生素1或2天。24進一步的解釋可能是膽汁排泄,許多經常處方的抗生素,如紅霉素或斯普拉霉素,可能是原因之一。
陸地總站是一種替代的生物標志物,可用於CRP。在歐洲國家的初級保健設置中,已經顯示陸地總站是減少急性呼吸道感染抗生素使用的有效生物標志物。25,26,27然而,據我們所知,迄今為止,尚無可在低收入地區使用的經濟可行的陸地總站即時測試。此外,2015年的一項研究28評估了陸地總站和CRP在區分南亞國家中瘧疾流行的3個南亞國家中常見的病毒和細菌感染方面的診斷準確性。該研究指出,當應用於單一感染的發熱患者樣本時,CRP對區分病毒感染和細菌感染(立克次體病/莱姆病、血液中檢測出的細菌感染)以及瘧疾方面是一個高度敏感且具有適度特異性的生物標志物。CRP在區分病毒感染和細菌感染方面的敏感性和特異性比陸地總站高。
由於樣本量大,我們的試驗在現實生活中評估了不同年齡亞組中的干預效應,這為我們提供了有關需要克服哪些障礙以使干預更加有效的相關數據。我們的研究結果表明,在低收入和中收入國家的初級保健設置中,CRP測試可能是急性呼吸道感染(成人和兒童)的非抗生素管理策略的重要組成部分,而不會影響患者的康復和滿意度。
在將CRP即時測試作為例行護理廣泛引入之前,應進行成本效益分析,以評估其他附加需求,包括測試成本、培訓和諮詢時間,與減少抗生素處方和後續抗藥性負擔相比。為了實現在越南等地抗生素消耗的最大影響,抗生素使用通常是非處方的,因此需要進一步研究CRP即時測試在藥房和藥店中的潛力。這個試驗提供了計劃這類研究所必需的重要數據。在社區環境中推出快速診斷測試可能有一些教訓。30
我們的研究有幾個局限性。隨著時間的推移,臨床醫師可能已經熟悉了與低CRP相關的臨床表現,導致即使在隨機分配到對照組的個體中,抗生素處方也減少了。集群隨機控制試驗設計可能已防止這種污染效應,但將更加昂貴。然而,這種限制將導致觀察到的效應減少而不是高估。我們可能未能捕獲所有在第二次訪問時的抗生素使用,日記、尿液測試和第14天的訪問。患者可能未報告抗生素使用,原因可能是記憶不好,自行認為誤用抗生素或不知道所給予的藥丸是抗生素。然而,這種偏差應在各組間平均分佈。最後,效果的異質性遠非理想,但可能代表了上下文的差異,將在定性分析中進一步探討,並且必須為成功實施這一策略而加以解決。
C-反應蛋白引導的抗生素使用可明顯減少急性呼吸道感染的抗生素使用。我們在十個保健站之間觀察到明顯的異質性,為實施提供了重要的教訓。我們的研究結果表明,該干預措施可以應用於資源有限的低收入和中收入國家的設置,以改善急性呼吸道感染患者(成人和兒童)的合理使用抗生素,而不會影響患者的康復和滿意度。
參考文獻
- 1.
Out-of-pocket health expenditures and antimicrobial resistance in low-income and middle-income countries: an economic analysis.
Lancet Infect Dis. 2015; 15: 1203-1210
- 2.
High prevalence of antimicrobial resistance among clinical Streptococcus pneumoniae isolates in Asia (an ANSORP study).
Antimicrob Agents Chemother. 2004; 48: 2101-2107
- 3.
Antibiotic use and resistance in emerging economies: a situation analysis for Viet Nam.
BMC Public Health. 2013; 13: 1158
- 4.
World Health Organization’s strategy to contain resistance to antimicrobial drugs.
Rev Panam Salud Publica. 2001; 10 (in Spanish).: 284-294
- 5.
Antibiotic sales in rural and urban pharmacies in northern Vietnam: an observational study.
BMC Pharmacol Toxicol. 2014; 15: 6
- 6.
Overprescribing of antibiotics to children in rural Vietnam.
Scand J Infect Dis. 2005; 37: 442-448
- 7.
Unnecessary antibiotic use for mild acute respiratory infections during 28-day follow-up of 823 children under five in rural Vietnam.
Trans R Soc Trop Med Hyg. 2011; 105: 628-636
- 8.
Visit complexity, diagnostic uncertainty, and antibiotic prescribing for acute cough in primary care: a retrospective study.
BMC Fam Pract. 2013; 14: 120
- 9.
Serum procalcitonin and C-reactive protein levels as markers of bacterial infection: a systematic review and meta-analysis.
Clin Infect Dis. 2004; 39: 206-217
- 10.
Performance of C-reactive protein and procalcitonin to distinguish viral from bacterial and malarial causes of fever in Southeast Asia.
BMC Infect Dis. 2015; (published online Nov 11.)
- 11.
Biomarkers as point-of-care tests to guide prescription of antibiotics in patients with acute respiratory infections in primary care.
Cochrane Database Syst Rev. 2014; 11 (CD010130.)
- 12.
Effects of internet-based training on antibiotic prescribing rates for acute respiratory-tract infections: a multinational, cluster, randomised, factorial, controlled trial.
Lancet. 2013; 382: 1175-1182
- 13.
Randomization and allocation concealment: a practical guide for researchers.
J Crit Care. 2005; 20: 187-191
- 14.
Usefulness of C-reactive protein testing in acute cough/respiratory tract infection: an open cluster-randomized clinical trial with C-reactive protein testing in the intervention group.
BMC Fam Pract. 2014; 15: 80
- 15.
Effect of point of care testing for C reactive protein and training in communication skills on antibiotic use in lower respiratory tract infections: cluster randomised trial.
BMJ. 2009; 338: b1374
- 16.
Use of time from fever onset improves the diagnostic accuracy of C-reactive protein in identifying bacterial infections.
Arch Dis Child. 2014; 99: 974-978
- 17.
C-reactive protein point-of-care testing for lower respiratory tract infections: a qualitative evaluation of experiences by GPs.
Fam Pract. 2010; 27: 212-218
- 18.
Detection of antimicrobial activity in urine for epidemiologic studies of antibiotic use.
J Clin Epidemiol. 1999; 52: 539-545
- 19.
Antibiotic screening of urine culture as a useful quality audit.
J Infect Dev Ctries. 2011; 5: 299-302
- 20.
Point-of-care C-reactive protein testing and antibiotic prescribing for respiratory tract infections: a randomized controlled trial.
Ann Fam Med. 2010; 8: 124-133
- 21.
The value of C-reactive protein testing in suspected lower respiratory tract infections. A study from general practice on the effect of a rapid test on antibiotic research and course of the disease in adults.
Tidsskr Nor Llaegeforen. 1995; 115 (in Norweigian).: 1610-1615
- 22.
Randomised controlled trial of CRP rapid test as a guide to treatment of respiratory infections in general practice.
Scand J Prim Health Care. 2000; 18: 39-43
- 23.
The measurement of observer agreement for categorical data.
Biometrics. 1977; 33: 159-174
- 24.
Decreased Streptococcus pneumoniae susceptibility to oral antibiotics among children in rural Vietnam: a community study.
BMC Infect Dis. 2010; 10: 85
- 25.
Procalcitonin-guided antibiotic use vs a standard approach for acute respiratory tract infections in primary care.
Arch Intern Med. 2008; 168: 2000-2007
- 26.
Procalcitonin guidance and reduction of antibiotic use in acute respiratory tract infection.
Eur Respir J. 2010; 36: 601-607
- 27.
Infection biomarkers in primary care patients with acute respiratory tract infections—comparison of Procalcitonin and C-reactive protein.
BMC Pulm Med. 2016; 16: 43
- 28.
Performance of C-reactive protein and procalcitonin to distinguish viral from bacterial and malarial causes of fever in Southeast Asia.
BMC Infect Dis. 2015; 15: 511
- 29.
Accuracy of commercially available c-reactive protein rapid tests in the context of undifferentiated fevers in rural Laos.
BMC Infect Dis. 2016; 16: 61
- 30.
Scale-up of malaria rapid diagnostic tests and artemisinin-based combination therapy: challenges and perspectives in sub-Saharan Africa.
PLoS Med. 2014; 11: e1001590



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย