本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
近期研究揭示,生酮飲食與標準化療和放射治療的結合,可能提升腫瘤治療效果。這種飲食策略,追溯至古代禁食療法,利用低碳水化合物和高脂肪的飲食來模擬禁食狀態,潛在地改善癌症患者的體質和腫瘤反應。然而,這方面的研究仍需更多的臨床試驗來證實其效果。
生酮飲食與癌症:新興的證據。
Ketogenic Diets and Cancer: Emerging Evidence
Jocelyn Tan-Shalaby, MD
Author information Copyright and License information PMC Disclaimer
PMCID: PMC6375425
PMID: 30766299
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6375425/
摘要
結合生酮飲食和標準的化療和放射治療方案可能有助於提高腫瘤反應,但仍需要進一步的研究。
早在公元前500年,禁食就被用作許多醫學疾病的有效治療方法。禁食繼續延續到現代,1910年,Guelpa和Marie提議使用禁食作為抗癲癇治療。1921年,Woodyatt指出,在沒有重大醫學合併症的個體中,斷食或使用高脂肪、低碳水化合物的飲食會產生醋酸酯和β-羥基丁酸,這是肝臟在缺乏葡萄糖的情況下產生的2種能源。低碳水化合物、高脂肪的飲食被認為是禁食或餓死的替代方案,具有許多相同的期望效果,同時繼續滋養健康的細胞。稍後,Wilder和Peterman提出了生酮飲食(KD)這一術語,他們制定了至今仍在使用的脂肪與碳水化合物的比例:兒童每公斤體重1克蛋白質,每天10至15克碳水化合物,其餘的熱量來自脂肪。兩位調查者都報告說這種飲食改善了他們患者的精神和認知。1
生酮飲食作為輔助癌症治療的使用也開始出現。1922年,Braunstein指出,當糖尿病患者被診斷出患有癌症後,尿液中的葡萄糖消失,這表明葡萄糖被招募到癌症區域,在那裡它的消耗速度超過正常速度。同一時期,諾貝爾獎得主Otto Warburg發現癌細胞依賴糖酵解生存,即使在充足的氧氣存在下也產生高乳酸水平。Warburg進行了許多體外和動物實驗,證明了這一結果,這一現象被稱為Warburg效應。
到20世紀中期,生酮飲食在癲癇治療和癌症研究中的使用減少了。然而,在20世紀90年代中後期,隨著Charlie Foundation的建立,該飲食慢慢開始重新獲得認可。1 許多體外和動物研究的結果被報告,人體數據也開始累積。
Abstract
Combining a ketogenic diet with standard chemotherapeutic and radiotherapeutic options may help improve tumor response, although more research is needed.
As early as 500 bc, fasting was used as an effective treatment for many medical ailments. Fasting continued into modern times, and in 1910, Guelpa and Marie proposed fasting as an antiepilepsy treatment. In 1921, Woodyatt noted that starvation or use of high-fat, low-carbohydrate diets in individuals with no significant medical comorbidities yielded acetone and β-hydroxybutyrate, 2 energy sources produced by the liver in the absence of glucose. A low-carbohydrate, high-fat diet was thought to be an alternative to fasting or starvation, having many of the same desired effects while continuing to nourish healthy cells. The term ketogenic diet (KD) was later coined by Wilder and Peterman, who formulated the fat-to-carbohydrate ratio that is still used today: 1 g protein per kg of body weight in children and 10 to 15 g carbohydrates daily, and fat for the remainder of calories. Both investigators reported that this diet improved their patients’ mentation and cognition.1
Use of the KD as an adjuvant to cancer therapy also began to emerge. In 1922, Braunstein noted that glucose disappeared from the urine of patients with diabetes after they were diagnosed with cancer, suggesting that glucose is recruited to cancerous areas where it is consumed at higher than normal rates. During that same time, Nobel laureate Otto Warburg found that cancer cells thrive on glycolysis, producing high lactate levels, even in the presence of abundant oxygen. Warburg conducted many in vitro and animal experiments demonstrating this outcome, known as the Warburg effect.
By the mid-20th century, KD use in epilepsy treatment and cancer research had waned. However, in the mid-to-late 1990s, with the establishment of the Charlie Foundation, the diet slowly started regaining recognition. 1 Results of many in vitro and animal studies were reported, and human data also began to accumulate.
作用機制
葡萄糖通常刺激胰臟β細胞釋放胰島素,使葡萄糖進入細胞並提供能量。當碳水化合物和葡萄糖攝入過多時,胰臟會分泌越來越多的胰島素,促使生長激素受體和生長激素相互作用,於肝臟製造胰島素樣生長因子1(IGF-1)— 這促進了細胞的生長和增殖,對患有癌症的病人可能有害。如正電子發射斷層掃描(PET)所見,許多癌症也出現了葡萄糖運輸蛋白1和3(Glut-1, Glut-3)的過度表達,與侵襲性腫瘤的葡萄糖攝取程度相對應。2 醣解的速率限制酶己糖激酶的過度表達進一步推動丙酮酸和乳酸的生產,導致活性氧物種的損害。己糖激酶速率限制酶從細胞質轉移到外部粒線體膜中,與電壓依賴性陰離子通道互動,可能會破壞瞬間降低依賴於caspase的細胞色素的釋放,這抑制了癌細胞的凋亡途徑,使癌症對化療更具抵抗性。3
當葡萄糖稀缺時,身體感覺到需要為細胞製造另一種形式的能量。然後肝臟產生酮和脂肪酸,這些可以為正常細胞提供能量,但對癌細胞沒有益處。癌細胞具有功能失常的粒線體和可能的電子傳遞鏈缺陷,這打亂了從粒線體正常產生腺苷酸三磷酸(ATP)的過程。結果是癌細胞嚴重依賴於來自較低效率的醣解過程的ATP(圖1)。
圖1 生酮飲食的代謝途徑生酮飲食模仿禁食狀態,此時身體因缺乏葡萄糖而開始產生酮體作為能量來源。過多的乳酸產生,作為瓦伯格效應的一部分,補償由於功能失常的粒線體氧化磷酸化所引起的ATP產生缺陷。2,4 由此產生的腫瘤依賴於葡萄糖可以通過使用生酮飲食來加以利用。生酮飲食選擇性地餓死腫瘤,提供脂肪和蛋白質,這些蛋白質和脂肪否則無法被依賴葡萄糖的腫瘤細胞使用。
在生酮飲食中,高脂肪和低碳水化合物的4:1比例模仿了禁食的代謝效應(圖2)。這些飲食通過抑制胰島素/IGF及其下游的細胞內信號傳導途徑,如磷酸肌醇3-激酶 (PI3K)/蛋白質激酶B (Akt)/哺乳動物雷帕霉素靶蛋白 (mTOR),來延緩癌症的進展。生酮飲食也增強腺苷酸酰化蛋白激酶(AMPK)的活性,該酶抑制有氧糖酵解並抑制腫瘤的增殖、侵襲和遷移。轉移性癌症的小鼠模型顯示,外源性酮體本身對腫瘤生存具有直接的細胞毒性效應。5 β-羥基丁酸鹽可以通過與組蛋白去乙酰化酶結合並因此抑制它,從而修飾染色質,最終抑制轉錄並抑制癌細胞的增殖(圖1)
圖2 生酮飲食的主要營養成分生酮飲食的好處
關於為有腎臟問題風險的病患提供蛋白質的議題存在一些疑慮。然而,患有糖尿病腎病的小鼠模型在使用生酮飲食後,其腎功能有所改善。這一假設是,使用生酮飲食會產生長時間的高3-β-羥基丁酸水平,從而減少對葡萄糖的分子反應,進而減少腎臟損傷。6 此飲食還降低了幼鼠和成年鼠的疼痛和炎症。其作用機制被認為是減少活性氧種和增加中樞腺苷水平。7,8
副作用
對於擔心體重進一步下降的癌症病人來說,節食是一個問題。標準飲食主要由碳水化合物組成,熱量價值高(圖3)。Beck 和 Tisdale 研究了在結腸癌小鼠模型中使用生酮飲食延緩消耗症的效果。他們發現,節食比胰島素更能有效地扭轉體重減少,且還附帶減少腫瘤大小的效果。7 而且,Tisdale 及其同事發現,對於消耗症的癌症病人使用生酮飲食可能促進體重增加。8
圖3 生酮飲食(阿特金斯)的大分子營養組成可能的解釋是,健康組織的營養選擇性地延遲了腫瘤的生長,而癌細胞被剝奪了營養(碳水化合物)。與非生酮飲食患者的病理性迅速體重減輕相比,生酮飲食的初期體重減輕後應該會出現治療性體重平台。9 腎結石、痛風和症狀性低血糖也是可能預期的不良效果(AEs)。
病例報告
1962年,紐約州精神衛生部發表了一篇文章,描述了2名女性,她們的轉移性癌症在一系列每日低血糖誘導的胰島素昏迷(短暫且可逆)後消失。由於這些患者不能接受常規的電擊治療,因此,選擇了醫學誘導的心理治療。她們的精神病和抑鬱症狀得到緩解,而且她們的癌症(顯著可見的宮頸癌和轉移性黑色素瘤)在治療開始後的2個月內變得難以檢測。10 Zuccoli和他的同事報告了一例胶质母细胞瘤,該病人在停用類固醇後使用替莫唑胺口服化療有效地進行了治療。病人經過放射學反應和良好的腫瘤控制約一年,然後停止飲食。她轉向化療,其中包括bevacizumab(抗血管內皮生長因子),但疾病進展,她去世了。11 此外,在生酮飲食8周期間,2名兒童女性星狀細胞瘤患者的心情得到了改善,並且在PET計算機斷層掃描(PET-CT)的腫瘤部位上顯示葡萄糖的攝取減少。其中一名患者繼續這種飲食並在接下來的12個月內保持無疾病。12 這些早期的病例報告為進一步研究葡萄糖代謝在癌症治療中的作用提供了有力的證據。
當前研究
與正常小鼠相比,放在低碳水化合物飲食上的帶腫瘤小鼠的葡萄糖、胰島素和乳酸水平較低。4 一項針對頭頸部癌症患者的體內微透析研究發現,經過4天的生酮飲食後,腫瘤組織中的乳酸水平下降。13 大部分涉及癌症中的生酮飲食的早期研究和病例報告都集中在腦腫瘤上。11,14-16 關於這種飲食在癌症護理中的人體臨床研究限於小型、非隨機、短期試驗(4-12週)或單一病例研究(表格)。11,17-20。
圖表1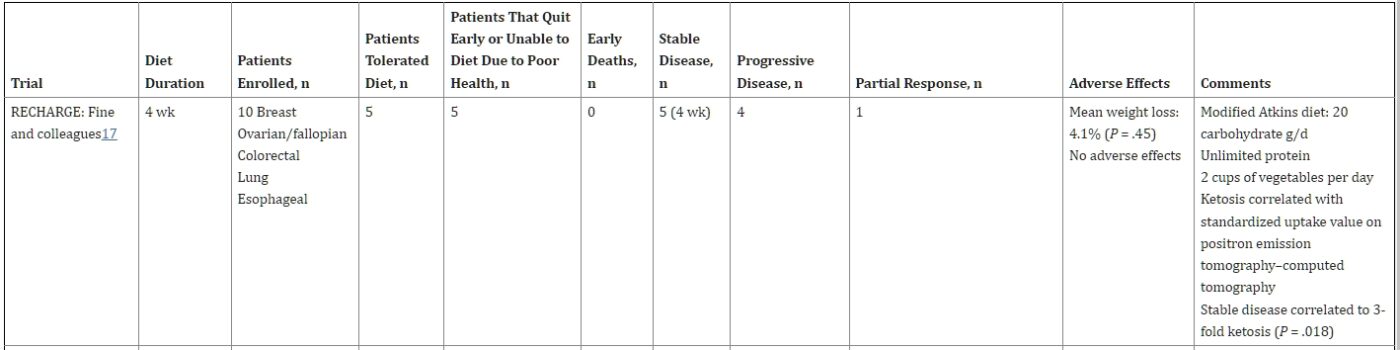
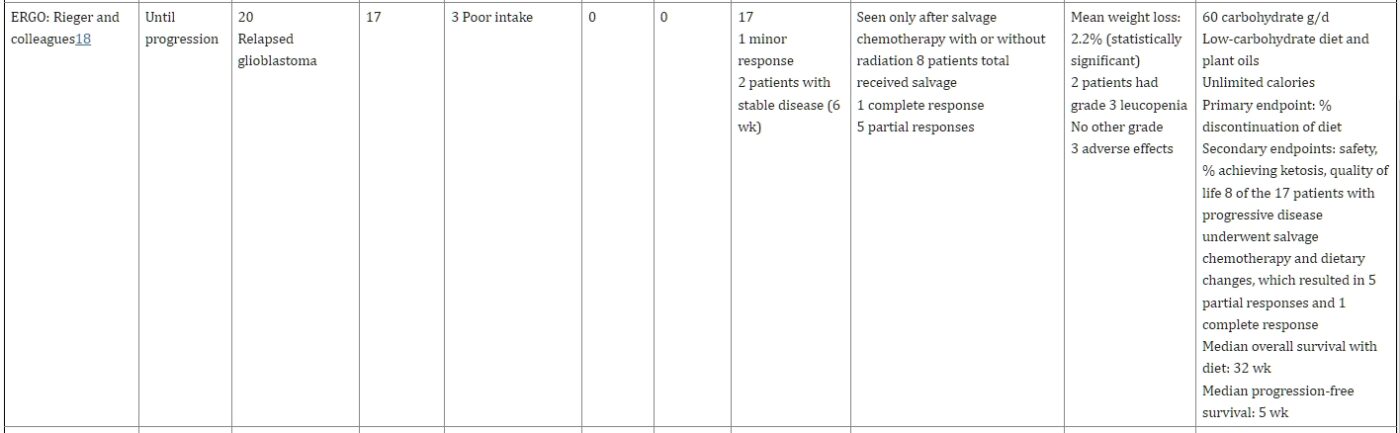

縮寫:ERGO, 用於復發性胶质母细胞瘤的生酮飲食;RECHARGE, 用於抵抗腫瘤增長的低碳水化合物。
Fine和他的同事進行了一項為期4周的可行性研究,對PET陽性的晚期實體腫瘤癌症患者進行了低碳水化合物的修飾阿特金斯KD(每日≤ 20克碳水化合物)。胰島素水平與酮症之間存在相關性,但與IGF無關。PET-CT上的穩定疾病或部分緩解(測量的標準攝取值)與酮症3倍高的相關性(但體重減少或減少的熱量攝入不相關)相比,患有進行性疾病的患者。17 在ERGO試驗中,Rieger和他的同事研究了20名復發性胶质母细胞瘤患者,他們正在服用添加了植物油的KD。18 熱量不受限制。主要終點是中斷飲食的患者百分比。平均體重顯著減少,但生活質量(QOL)得到維持。在小鼠胶质母细胞瘤模型中,研究人員還研究了單獨KD或與bevacizumab結合的效果。在這項小鼠研究中,KD單獨沒有效果;但是,它將中位生存期從52天增加到58天(P < .05)與bevacizumab。
在一項初步研究中,Schmidt和他的同事為16名患有各種晚期轉移性癌症的患者中的7名提供了KD加油蛋白震蕩作為小吃。平均體重損失在統計學上是顯著的,血脂或膽固醇水平保持穩定,某些QOL指標得到改善,並且沒有嚴重的AEs。19 Schwartz和他的同事回顧了32名接受能量限制KD治療的胶质瘤患者的病例-來自病例報告的5名,來自Rieger和同事的臨床試驗的19名,以及來自Champ的8名。18,20,21 他們還報告了自己的2例使用能量限制KD治療的胶质瘤病例,並研究了組織中關鍵酮酸酶的表達。在這些病例報告中,從4個月到5年以上都注意到了持續的緩解。20
VA匹茲堡醫療系統的安全性試驗招募了17名患者,其中11名進行了評估。平均體重顯著減少,且反應者(穩定或改善的疾病)的體重減少≥10%與非反應者相比被注意到。有三名患者的飲食時間超過16週(存活,80-116週)。其中一名患者在121週時仍然活著。22
安全性和可行性數據表明,癌症患者可以忍受KD的使用。研究人員應考慮將KD方法與標準治療方法相結合,包括化療和放射線治療。
研究人員已在體外進行了關於腫瘤組織中酮酸和糖酵解酶基因表達對KD反應的影響的研究。表達關鍵粒線體氧化磷酸化酶突變的腫瘤比未發生突變的腫瘤更可能對KD的使用產生反應。16,23
正在進行的臨床試驗
杜克大學已啟動了一項隨機研究(NCT00932672),研究阿特金斯飲食和攝護腺癌患者的雄激素剝奪治療。以色列的特拉維夫索拉斯基醫學中心正在招募以前接受過化療放療的高級別胶质瘤患者,進行一項開放標籤研究(NCT01092247),評估KD在防止腫瘤生長和復發中的效果。聖約瑟夫醫院和醫學中心(亞利桑那州鳳凰城)正在招募新診斷的胶质母细胞瘤患者,進行一項1/2期前瞻性試驗(NCT02046187),涉及首次切除後隨即進行KD,配合放射治療和同時使用替莫唑胺,然後進行替莫唑胺輔助化療。主要終點是出現AEs的患者數量,次要終點是整體存活率、進展到時間和生活質量。愛荷華大學正在招募攝護腺癌和非小細胞肺癌患者進行2項1期研究(NCT01419483和NCT01419587),涉及使用Nutritia KetoCal 4:1(馬里蘭州蓋瑟斯堡)的KD。
結論
來自病例報告和試驗的數據建議癌症患者使用KD是安全和可容忍的。雖然理想的情況是使用隨機治療方法進行更大的試驗,但當前對基於藥物的試驗的重視是一個強大的障礙。其他主要的障礙是患者的主動性和遵從性。目前,研究者必須使用軼事數據進行工作。檢查線粒體中的基因表達模式以及ketolytic和glycolytic酶中的突變可能有助於選擇可能有反應的患者。將這種飲食方法與標準的化療和放療選項結合,可能有助於改善腫瘤反應,並且迫切需要進一步的研究。
圖 4 標準飲食的營養素組成參考資料
1. Wheless JW. History of the ketogenic diet. Epilepsia. 2008;49(suppl 8):3–5. [PubMed] [Google Scholar]2. Tian M, Zhang H, Nakasone Y, Mogi K, Endo K. Expression of Glut-1 and Glut-3 in untreated oral squamous cell carcinoma compared with FDG accumulation in a PET study. Eur J Nucl Med Mol Imaging. 2004;31(1):5–12. [PubMed] [Google Scholar]3. Pastorino JG, Hoek JB. Regulation of hexokinase binding to VDAC. J Bioenerg Biomembr. 2008;40(3):171–182. [PMC free article] [PubMed] [Google Scholar]4. Ho VW, Leung K, Hsu A, et al. A low carbohydrate, high protein diet slows tumor growth and prevents cancer initiation. Cancer Res. 2011;71(13):4484–4493. [PubMed] [Google Scholar]5. Poff AM, Ari C, Arnold P, Seyfried TN, D’Agostino DP. Ketone supplementation decreases tumor cell viability and prolongs survival of mice with metastatic cancer. Int J Cancer. 2014;135(7):1711–1720. [PMC free article] [PubMed] [Google Scholar]6. Poplawski MM, Mastaitis JW, Isoda F, Grosjean F, Zheng F, Mobbs CV. Reversal of diabetic nephropathy by a ketogenic diet. PLoS One. 2011;6(4):e18604. [PMC free article] [PubMed] [Google Scholar]7. Beck SA, Tisdale MJ. Effect of insulin on weight loss and tumour growth in a cachexia model. Br J Cancer. 1989;59(5):677–681. [PMC free article] [PubMed] [Google Scholar]8. Tisdale MJ, Brennan RA, Fearon KC. Reduction of weight loss and tumour size in a cachexia model by a high fat diet. Br J Cancer. 1987;56(1):39–43. [PMC free article] [PubMed] [Google Scholar]9. Tan-Shalaby J, Seyfried T. Ketogenic diet in advanced cancer: a pilot feasibility and safety trial in the Veterans Affairs cancer patient population. J Clin Trials. 2013;3(4):149. [Google Scholar]10. Koroljow S. Two cases of malignant tumors with metastases apparently treated successfully with hypoglycemic coma. Psychiatr Q. 1962;36:261–270. [PubMed] [Google Scholar]11. Zuccoli G, Marcello N, Pisanello A, et al. Metabolic management of glioblastoma multiforme using standard therapy together with a restricted ketogenic diet: case report. Nutr Metab (Lond) 2010;7:33. [PMC free article] [PubMed] [Google Scholar]12. Nebeling LC, Miraldi F, Shurin SB, Lerner E. Effects of a ketogenic diet on tumor metabolism and nutritional status in pediatric oncology patients: two case reports. J Am Coll Nutr. 1995;14(2):202–208. [PubMed] [Google Scholar]13. Masino SA, Ruskin DN. Ketogenic diets and pain. J Child Neurol. 2013;28(8):993–1001. [PMC free article] [PubMed] [Google Scholar]14. Maroon J, Bost J, Amos A, Zuccoli G. Restricted calorie ketogenic diet for the treatment of glioblastoma multiforme. J Child Neurol. 2013;28(8):1002–1008. [PubMed] [Google Scholar]15. Schroeder U, Himpe B, Pries R, Vonthein R, Nitsch S, Wollenberg B. Decline of lactate in tumor tissue after ketogenic diet: in vivo microdialysis study in patients with head and neck cancer. Nutr Cancer. 2013;65(6):843–849. [PubMed] [Google Scholar]16. Chang HT, Olson LK, Schwartz KA. Ketolytic and glycolytic enzymatic expression profiles in malignant gliomas: implication for ketogenic diet therapy. Nutr Metab (Lond) 2013;10(1):47. [PMC free article] [PubMed] [Google Scholar]17. Fine EJ, Segal-Isaacson CJ, Feinman RD, et al. Targeting insulin inhibition as a metabolic therapy in advanced cancer: a pilot safety and feasibility dietary trial in 10 patients. Nutrition. 2012;28(10):1028–1035. [PubMed] [Google Scholar]18. Rieger J, Bähr O, Maurer GD, et al. ERGO: a pilot study of ketogenic diet in recurrent glioblastoma. Int J Oncol. 2014;44(6):1843–1852. [published correction appears in Int J Oncol 2014; 45(6): 2605] [PMC free article] [PubMed] [Google Scholar]19. Schmidt M, Pfetzer N, Schwab M, Strauss I, Kämmerer U. Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer: a pilot trial. Nutr Metab (Lond) 2011;8(1):54. [PMC free article] [PubMed] [Google Scholar]20. Schwartz K, Chang HT, Nikolai M, et al. Treatment of glioma patients with ketogenic diets: report of two cases treated with an IRB-approved energy-restricted ketogenic diet protocol and review of the literature. Cancer Metab. 2015;3:3. [PMC free article] [PubMed] [Google Scholar]21. Champ CE, Palmer JD, Volek JS, et al. Targeting metabolism with a ketogenic diet during the treatment of glioblastoma multiforme. J Neurooncol. 2014;117(1):125–131. [PubMed] [Google Scholar]22. Tan-Shalaby J, Carrick J, Edinger K, et al. Modified ketogenic diet in advanced malignancies—final results of a safety and feasibility trial within the Veterans Affairs Healthcare System. J Clin Oncol. 2016;34(suppl) Abstract e23173. [PMC free article] [PubMed] [Google Scholar]23. Langbein S, Zerilli M, Zur Hausen A, et al. Expression of transketolase TKTL1 predicts colon and urothelial cancer patient survival: Warburg effect reinterpreted. Br J Cancer. 2006;94(4):578–585. [PMC free article] [PubMed] [Google Scholar]



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย