本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
一項為期12個月的研究比較了低碳水化合物飲食和低脂飲食對食慾相關激素和自我報告的食慾變化的影響。結果顯示,低脂飲食在降低多肽YY水平方面表現更優,這意味著它更能增加飽腹感。然而,兩種飲食在ghrelin的變化和自我報告的食慾變化方面沒有差異。總的來說,這項研究提供了有關不同飲食組成對食慾的影響的重要信息,對於那些希望減肥或控制食慾的人們可能有所幫助。

低碳水化合物飲食對食慾的影響:一項隨機對照試驗。
The Effects of a Low-Carbohydrate Diet on Appetite: A Randomized Controlled Trial
Hu T, Yao L, Reynolds K, Niu T, Li S, Whelton P, He J, Bazzano L. The effects of a low-carbohydrate diet on appetite: A randomized controlled trial. Nutr Metab Cardiovasc Dis. 2016 Jun;26(6):476-88. doi: 10.1016/j.numecd.2015.11.011. Epub 2015 Dec 12. PMID: 26803589; PMCID: PMC4873405.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4873405/
Abstract
Background and aims
The relationship between dietary macronutrient composition and appetite is controversial. We examined the effects of a yearlong low-carbohydrate diet compared to a low-fat diet on appetite-related hormones and self-reported change in appetite.
Methods and results
A total of 148 adults with a body mass index 30–45 kg/m2, who were free of diabetes, cardiovascular disease and chronic kidney disease at baseline were randomly assigned to either a low-carbohydrate diet (carbohydrate [excluding dietary fiber]<40 g/day; N=75) or a low-fat diet (<30% energy from fat, <7% from saturated fat; N=73). Participants in both groups attended individual and group dietary counseling sessions where they were provided the same behavioral curriculum and advised to maintain baseline levels of physical activity. Appetite and appetite-related hormones were measured at 0, 3, 6 and 12 months of intervention. At 12 months, mean changes (95% CI) in peptide YY were −34.8 pg/mL (−41.0 to −28.6) and in the low-carbohydrate group and −44.2 pg/mL (−50.4 to −38.0) in the low-fat group (net change: 9.4 pg/mL [0.6 to 18.2 pg/mL]; p=0.036). Approximately 99% of dietary effects on peptide YY are explained by differences in dietary macronutrient content. There was no difference in change in ghrelin or self-reported change in appetite between the groups.
Conclusions
A low-fat diet reduced peptide YY more than a low-carbohydrate diet. These findings suggest that satiety may be better preserved on a low-carbohydrate diet, as compared to a low fat diet.
摘要
背景和目的
飲食中的大量營養素組成與食慾之間的關係存在爭議。我們比較了長達一年的低碳水化合物飲食與低脂飲食對食慾相關激素和自我報告的食慾變化的影響。
方法和結果
共有148名成人參與,他們的身體質量指數為30-45 kg/m²,且在基線時沒有糖尿病、心血管疾病和慢性腎病。參與者被隨機分配到低碳水化合物飲食組(碳水化合物[不含膳食纖維]<40 g/天;N=75)或低脂飲食組(<30%能量來自脂肪,<7%來自飽和脂肪;N=73)。兩組參與者都參加了個別和小組飲食諮詢會議,他們在會議中獲得相同的行為課程,並被建議維持基線水平的身體活動。在干預的0、3、6和12個月測量食慾和食慾相關激素。在12個月時,多肽YY的平均變化(95% CI)在低碳水化合物組為-34.8 pg/mL(-41.0至-28.6)和低脂組為-44.2 pg/mL(-50.4至-38.0)(净变化:9.4 pg/mL [0.6至18.2 pg/mL]; p=0.036)。約99%的飲食效果對多肽YY的影響可以通過飲食中大量營養素的差異來解釋。兩組之間在ghrelin的變化或自我報告的食慾變化上沒有差異。
結論
低脂飲食比低碳水化合物飲食更能降低多肽YY。這些發現表明,與低脂飲食相比,低碳水化合物飲食可能更好地保持飽腹感。
引言
在過去的幾十年中,飲食中大量營養素含量的調整,特別是對碳水化合物和脂肪的限制,已被廣泛用於減肥和體重控制。尚不清楚由於限制碳水化合物或脂肪而導致的體重減少是由於食慾或食慾相關激素的變化所致。食慾是一種複雜的現象,受到行為和生物特性的共同影響。胃腸道合成和釋放的多種肽類是食慾的重要調節器。例如,ghrelin由胃分泌,作為增加飢餓感、刺激食物攝入和降低脂肪組織中脂肪利用的食慾信號。相反,多肽YY在餐後從小腸遠端和結腸釋放,通過增加飽腹感來降低食慾。減重會增加如ghrelin等刺激食慾的激素,並減少如PYY等飽腹激素。測量這些與食慾相關的激素可能提供關於飲食變化對食慾生物標記的新穎和客觀見解。
低碳水化合物飲食在減肥和體重管理方面已被證明是有效的。以往對低碳水化合物飲食的研究提供了一些證據,表明這些飲食可能通過自我報告測量來降低食慾,而少數幾個小型研究(N<50)則顯示相反的結果。最近對此話題的後設分析得出結論,生酮低碳水化合物飲食從基線測量中略微降低了食慾,但由於符合納入標準的研究數量少,且沒有非生酮飲食的對照組,因此無法與非生酮飲食進行比較。降低食慾的潛在機制尚不清楚,但可能涉及與食慾相關的激素。迄今為止,關於碳水化合物限制對食慾相關激素的影響的數據很少,僅限於幾個小型、短期研究。本研究的目的是考察減肥飲食中的大量營養素組成是否影響食慾及其調節,反映在這些食慾激素的水平上,以及這些影響在多大程度上獨立於減肥本身。因此,我們比較了低碳水化合物飲食與低脂飲食在12個月內對148名肥胖成人的食慾相關激素和自我報告的食慾變化的影響。
參與者和方法
研究參與者
肥胖成年人通過報紙和電視廣告、大量郵寄和電子郵件在大新奧爾良地區招募而來。參與者的資格標準為身體質量指數為30至45 kg/m²,年齡在22至75歲之間。懷孕或在基線時患有2型糖尿病、心血管疾病或慢性腎病的個體未被納入研究。所有程序均獲得了杜蘭大學健康科學中心機構審查委員會的批准,所有參與者均提供了書面知情同意。
研究方案
該研究設計已在其他地方詳細描述。簡而言之,這項試驗旨在檢驗低碳水化合物飲食對體重和心血管風險因素的影響。148名參與者被隨機分配遵循低碳水化合物飲食(每日可消化碳水化合物攝入量(總碳水化合物減去總纖維)<40克;N=75),或低脂肪飲食(限制總脂肪和飽和脂肪攝入量分別<30%和<7%的日常能量;N=73)。參與者在第一個月每週參加一次個別飲食諮詢會議,之後每兩週參加一次小組會議5個月,並在剩餘6個月每月進行一次會議。在諮詢會議期間,參與者與研究營養師會面,獲得可選食譜,並接受支持性諮詢。同一行為課程,包括有關膳食纖維(推薦攝入量為每天25克)和飲食脂肪類型的信息,被提供給兩組人,並在干預過程中未作更改。這些共同指導強調單不飽和脂肪的好處,並建議限制或消除反式脂肪。參與者被建議保持他們的基線身體活動水平,這是在每次隨訪時使用驗證措施評估的。
由訓練有素的研究人員在基線時獲得詳細的醫療史、藥物使用和生活方式風險因素信息。體重和其他測量在基線和每次隨訪時使用標準化方法獲得。由認證的研究營養師在基線和每次隨訪時從每位參與者那裡獲得兩次24小時飲食回顧。其中一次回顧在工作日進行,另一次在週末進行。為了質量控制,5%的回顧被錄音以供審查。使用研究營養數據系統軟件中包含的食品成分表計算飲食營養攝入量。
測量結果變量
在干預開始時、3個月、6個月和12個月的診所訪問期間收集血液樣本。食慾相關激素,包括多肽YY和ghrelin,由哥倫比亞大學醫學中心的Irving研究所臨床和轉化研究生物標記核心實驗室測量。多肽YY使用放射免疫分析方法和商業可用試劑(Millipore,比勒里卡,馬薩諸塞州)測量。多肽YY的試驗間變異系數為7.1%。Ghrelin使用放射免疫分析方法和商業可用試劑盒(Linco Research,聖查爾斯,密蘇里州)測量。Ghrelin的試驗間變異系數為17.8%。在每次隨訪訪問時,還要求參與者報告他們是否經歷了食慾變化(是或否)。
統計分析
基線特徵,包括與食慾相關的激素,呈正態分佈,以分配的飲食組別表示,並使用t檢驗或卡方檢驗在組間進行比較。飲食組成數據以平均值(標準差)呈現,並在基線和每次隨訪時使用t檢驗進行比較。為了研究食慾相關激素的變化,我們使用了一個包括隨機截距和隨機斜率的隨機效應線性模型,以調整重複測量中參與者之間的相關性,包括時間(3、6和12個月)的指示變量、飲食組、飲食組和時間的交互作用項,以及對應食慾激素的基線水平。這種建模技術允許在缺失數據的假設下進行數據分析。為了在缺失數據存在的情況下測試結論的穩健性,我們使用多重插補技術進行敏感性分析,包括在模型中添加額外的協變量(年齡、性別、種族、婚姻狀況、教育和就業狀況)。為了評估自報食慾變化(二元)的效應,我們使用了具有logit鏈接函數的廣義估計方程(GEE)模型,以考慮個體內重複測量的相關性。為了將大量營養素組成的效應與減肥本身對食慾相關激素變化的效應分開,我們進行了一個中介分析。這種統計分析估計了飲食的大量營養素組成對食慾測量的影響。作為第二步,估計了減肥對食慾測量的影響。在第三和最後一步中,減肥對食慾測量的影響被減去,從而可以分離出飲食的大量營養素組成對食慾測量的影響,消除了減肥本身的影響。我們繪製了個人水平數據,以進一步研究碳水化合物攝入量、食慾激素和減肥之間的關係。所有分析都是根據意向治療原則進行的。所有P值均為雙側檢驗,統計學上顯著性定義為P <0.05。我們使用SAS(9.3版本;SAS Institute Inc,北卡羅來納州凱利)進行所有分析。
結果
在這個研究樣本中,平均年齡為46.8歲(標準差10.2歲),11.5%為男性,51%為非洲裔美國人。在3、6和12個月時,低脂組分別有93%、88%和82%的受試者完成了評估,低碳水化合物組則分別有92%、83%和79%的受試者完成了評估。基線時的人口特徵、心血管風險因素和食慾相關激素請參見表1。如先前報導,平均而言,低脂組的受試者在12個月時減重1.5公斤,低碳水化合物組的受試者在12個月時減重5.3公斤[26]。
表1 試驗參與者的基線特徵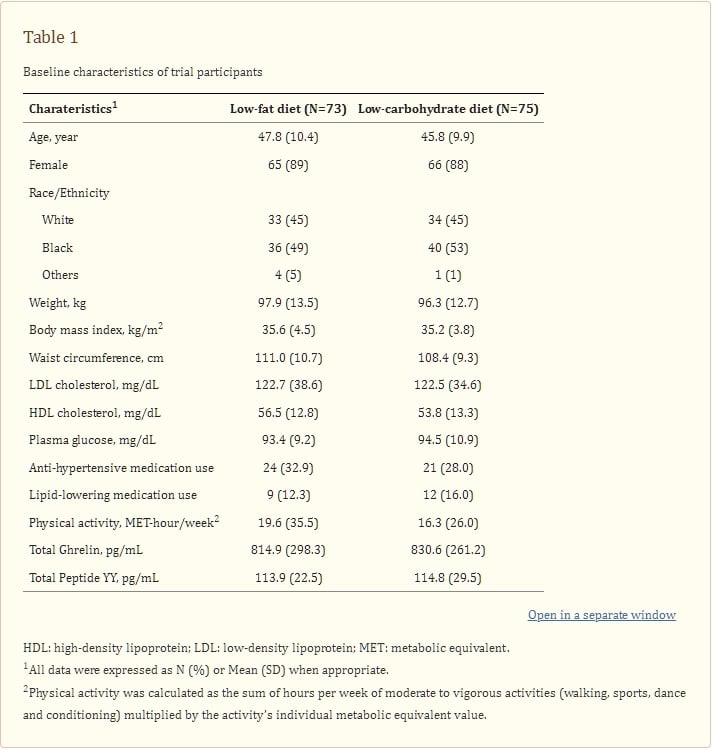
參與者每日飲食組成的數據,對於仍然遵循每種飲食並提供24小時飲食回憶的參與者,見表2。基線數據顯示,在兩組之間的總能量、碳水化合物、脂肪或蛋白質攝入方面沒有顯著差異。在12個月時,低碳水化合物組的碳水化合物攝入量顯著低於低脂組,而蛋白質或脂肪(總脂肪、飽和脂肪和不飽和脂肪)攝入量顯著高於低脂組。
表2 研究期間內低脂飲食組和低碳水化合物飲食組的每日飲食組成1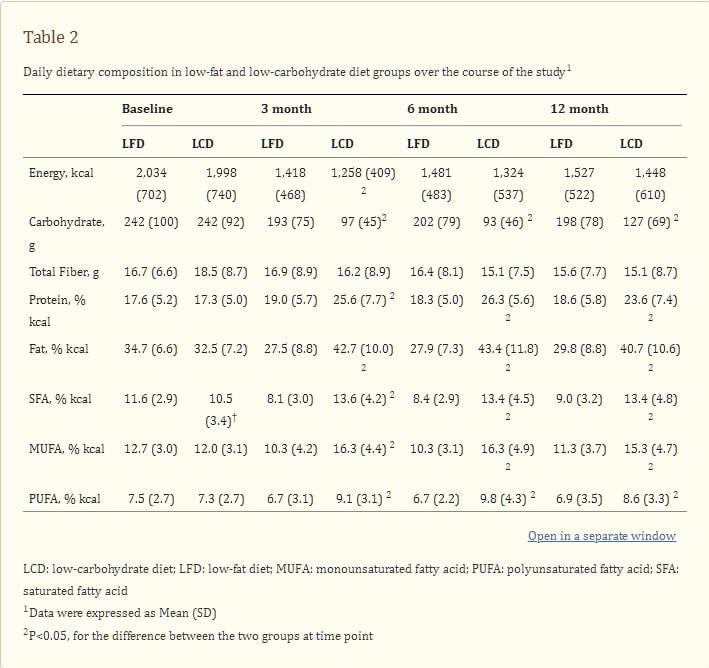
表3顯示了根據指定的飲食組別,在總胃餓素和總胜肽YY的變化方面,從基線預測的均值差異(95%置信區間)。在12個月內,總胜肽YY水平在低脂組和低碳水化合物組中都下降,但在低碳水化合物組中下降程度比低脂組要小(12個月變化的平均差異為9.4 pg/mL [95% CI,0.6至18.2 pg/mL];P=0.036)。在整個研究期間,兩組之間的胃餓素變化的均值差異在統計學上不顯著。兩組之間的自報食慾變化無顯著差異(未顯示數據)。
表3 根據指定的飲食組別,從基線預測的食慾激素變化的均值差異
中介分析顯示,99.6% 的腸肽YY差異是由兩種飲食的宏量營養成分差異解釋的,而不是體重減輕所致。我們還分別檢查了黑人和白人參與者在食慾相關激素變化方面的差異,並發現類似的趨勢(附錄表1和表2)。對於考慮缺失數據的敏感性分析的結果與我們主要分析中呈現的結果一致。
附錄表1 預測的食慾相關激素變化均值差異(相對於基線)按照分配的飲食組在白人中1

附錄圖1-4顯示了隨機分配的飲食組別之間的碳水化合物成分、能量攝入、體重減輕和食慾激素之間的關係。 碳水化合物攝入(每日能量攝入的%)的減少在整個研究期間與體重減輕密切相關(附錄圖1)。
附錄圖1 附錄圖1討論
在這個為期12個月的隨機對照試驗中,低脂飲食比低碳水化合物飲食更顯著地降低了飽腹信號濃度的胜肽YY。這些結果表明,與低脂飲食相比,低碳水化合物飲食可能更有助於保持飽腹感。儘管我們的研究未能通過單一問題評估識別出飲食組之間在自報食慾改變方面的差異,但我們已經先前報告過低碳水化合物飲食確實比低脂飲食更有效地減少整體體重[26]。值得注意的是,約99%的飲食對YY胜肽的效應可以解釋為飲食中營養素成分的差異,而不是體重減少。我們的研究是關於減重的低碳水化合物飲食的最大的隨機對照試驗,旨在研究食慾相關激素的變化,並且是第一個與更常見的用於減重和改善心臟疾病風險因子的低脂飲食進行比較的試驗。
一些小規模的研究已經研究了低碳水化合物飲食對食慾相關激素的影響。對於9名肥胖糖尿病患者的數據,研究了他們在典型的西方飲食(攝入碳水化合物21克/天)和低碳水化合物飲食(攝入碳水化合物21克/天)中的食慾激素水平變化,結果顯示低碳水化合物飲食引起了(p=0.044)ghrelin水平的輕微增加[24]。在一項隨機的、兩期的、交叉研究中,對18名肥胖男性和女性進行了為期1週的低脂飲食(熱量的<20%來自脂肪)和低碳水化合物飲食(熱量的<15%來自碳水化合物)的飲食試驗,結果發現在兩個飲食組之間在空腹狀態下peptide YY的變化方面沒有顯著差異[25]。這兩個試驗的樣本數非常有限,而且隨訪時間相對較短[24,25]。相反,我們的試驗包括了148名沒有糖尿病的男性和女性,並在為期12個月的隨訪期間測試了飲食對食慾相關激素的影響。
其他研究試圖區分飲食中各種營養素對食慾的影響。例如,「選擇性營養攝入試驗以預防心臟病」(OMNI-Heart)的數據研究了3種不同營養素的飲食效應,但沒有測試典型的低碳水化合物減重飲食[34]。在OMNI-Heart中,參與者被餵養以維持其當前的體重[34]。相反,我們的試驗測試了一種典型的低碳水化合物減重飲食的效應,該飲食將碳水化合物攝取限制在每天不到40克,並且沒有為蛋白質和脂肪的攝取設定特定的能量目標。我們將低碳水化合物飲食與廣泛推薦的低脂飲食進行了比較,該飲食將總脂肪攝入限制在每天熱量的<30%,飽和脂肪攝入限制在每天熱量的<7%。通過這種方式,我們確定了一個多樣化人口中常用於減重的飲食模式對食慾相關激素的影響。
食慾相關激素的不同變化可能解釋了我們觀察到的兩種飲食之間體重減輕和保持的差異。體重減輕伴隨著多種補償性生理變化,包括食慾相關激素的適應性變化[6,7]。因此,我們的研究結果顯示,在12個月內,低碳水化合物飲食比低脂飲食更有利於保持飽腹感的YY胜肽水平,這表明對於減重來說具有更有利的生理環境。
我們的結論存在一些限制。我們僅通過一個問題評估了食慾,並且缺乏有關飢餓和飽腹等各種方面的詳細信息。我們只評估了ghrelin和YY胜肽等食慾相關激素,而未評估其他激素。這個臨床試驗並不具備測試食慾相關激素的統計功率。但是,我們具有卓越的統計功率,可以檢測低碳水化合物和低脂飲食對食慾相關激素的影響,並且檢測到了具有統計學意義的比較。自報的膳食信息可能會受到回想問題的影響;但是,我們在攝入後的24小時內收集了膳食數據。營養師對研究假設不是盲目的。為了避免由於這一點而導致的飲食指導的潛在差異,我們為所有指導會話使用了具體和詳細的腳本,並訓練工作人員傳遞腳本而不偏離。獨立的註冊營養師會定期觀察兩組的飲食會話,以確保一致性,並且所有結果評估者對飲食組分配保持了盲目。
此外,這項研究還具有一些優點,這些優點增強了這些發現的可信度。這項研究既包括了食慾相關激素的測量,也包括了自報的食慾測量。所有數據都是由經過訓練和認證的工作人員使用嚴格的質量控制協議收集的。此外,該研究中包含了一定比例的黑人參與者,這是以前試驗中未充分代表的一個群體,這使得研究種族差異的檢查成為可能。最後,兩個干預組的完成率約為80%。
總之,這項為期12個月的隨機對照試驗表明,低碳水化合物飲食在減重的目的下可能比低脂飲食更有助於保持飽腹感。以前的研究提供的有限證據表明,低碳水化合物飲食,通常富含脂肪和蛋白質,可能會減少食慾[23]。我們研究中關於食慾相關激素的差異模式可能部分解釋了這種對食慾的潛在影響。
附錄圖2 附錄圖3- 我們研究了為期12個月的低碳水化合物飲食對食慾的影響。
- 低碳水化合物飲食導致YY胜肽水平下降的幅度小於低脂飲食。
- 不到1%的YY胜肽的膳食效應可以通過體重減輕來解釋。
參考文獻
1. Howard AD, Feighner SD, Cully DF, Arena JP, Liberator PA, Rosenblum CI, Hamelin M, Hreniuk DL, Palyha OC, Anderson J, Paress PS, Diaz C, Chou M, Liu KK, McKee KK, Pong SS, Chaung LY, Elbrecht A, Dashkevicz M, Heavens R, Rigby M, Sirinathsinghji DJ, Dean DC, Melillo DG, Patchett AA, Nargund R, Griffin PR, DeMartino JA, Gupta SK, Schaeffer JM, Smith RG, Van der Ploeg LH. A receptor in pituitary and hypothalamus that functions in growth hormone release. Science. 1996;273:974–977. [PubMed] [Google Scholar]
2. Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 1999;402:656–660. [PubMed] [Google Scholar]
3. Pinkney J, Williams G. Ghrelin gets hungry. Lancet. 2002;359:1360–1361. [PubMed] [Google Scholar]
4. Adrian TE, Ferri GL, Bacarese-Hamilton AJ, Fuessl HS, Polak JM, Bloom SR. Human distribution and release of a putative new gut hormone, peptide YY. Gastroenterology. 1985;89:1070–1077. [PubMed] [Google Scholar]
5. Adrian TE, Savage AP, Sagor GR, Allen JM, Bacarese-Hamilton AJ, Tatemoto K, Polak JM, Bloom SR. Effect of peptide YY on gastric, pancreatic, and biliary function in humans. Gastroenterology. 1985;89:494–499. [PubMed] [Google Scholar]
6. Sumithran P, Proietto J. The defence of body weight: a physiological basis for weight regain after weight loss. Clin Sci (Lond) 2013;124:231–241. [PubMed] [Google Scholar]
7. Cummings DE, Weigle DS, Frayo RS, Breen PA, Ma MK, Dellinger EP, Purnell JQ. Plasma ghrelin levels after diet-induced weight loss or gastric bypass surgery. N Engl J Med. 2002;346:1623–1630. [PubMed] [Google Scholar]
8. Essah PA, Levy JR, Sistrun SN, Kelly SM, Nestler JE. Effect of weight loss by a low-fat diet and a low-carbohydrate diet on peptide YY levels. Int J Obes (Lond) 2010;34:1239–1242. [PMC free article] [PubMed] [Google Scholar]
9. Brubaker PL. Regulation of intestinal proglucagon-derived peptide secretion by intestinal regulatory peptides. Endocrinology. 1991;128:3175–3182. [PubMed] [Google Scholar]
10. Hu T, Mills KT, Yao L, Demanelis K, Eloustaz M, Yancy WS, Jr, Kelly TN, He J, Bazzano LA. Effects of low-carbohydrate diets versus low-fat diets on metabolic risk factors: a meta-analysis of randomized controlled clinical trials. Am J Epidemiol. 2012;176(Suppl 7):S44–54. [PMC free article] [PubMed] [Google Scholar]
11. Hu T, Bazzano LA. The low-carbohydrate diet and cardiovascular risk factors: Evidence from epidemiologic studies. Nutr Metab Cardiovasc Dis. 2014;24:337–343. [PMC free article] [PubMed] [Google Scholar]
12. Feinman RD, Pogozelski WK, Astrup A, Bernstein RK, Fine EJ, Westman EC, Accurso A, Frassetto L, Gower BA, McFarlane SI, Nielsen JV, Krarup T, Saslow L, Roth KS, Vernon MC, Volek JS, Wilshire GB, Dahlqvist A, Sundberg R, Childers A, Morrison K, Manninen AH, Dashti HM, Wood RJ, Wortman J, Worm N. Dietary carbohydrate restriction as the first approach in diabetes management: critical review and evidence base. Nutrition. 2015;31:1–13. [PubMed] [Google Scholar]
13. Westman EC, Feinman RD, Mavropoulos JC, Vernon MC, Volek JS, Wortman JA, Yancy WS, Phinney SD. Low-carbohydrate nutrition and metabolism. Am J Clin Nutr. 2007;86:276–284. [PubMed] [Google Scholar]
14. Paoli A, Rubini A, Volek JS, Grimaldi KA. Beyond weight loss: a review of the therapeutic uses of very-low-carbohydrate (ketogenic) diets. Eur J Clin Nutr. 2013;67:789–796. [PMC free article] [PubMed] [Google Scholar]
15. Johnstone AM, Horgan GW, Murison SD, Bremner DM, Lobley GE. Effects of a high-protein ketogenic diet on hunger, appetite, and weight loss in obese men feeding ad libitum. Am J Clin Nutr. 2008;87:44–55. [PubMed] [Google Scholar]
16. Lobley GE, Johnstone AM, Fyfe C, Horgan GW, Holtrop G, Bremner DM, Broom I, Schweiger L, Welch A. Glucose uptake by the brain on chronic high-protein weight-loss diets with either moderate or low amounts of carbohydrate. Br J Nutr. 2014;111:586–597. [PubMed] [Google Scholar]
17. McClernon FJ, Yancy WS, Jr, Eberstein JA, Atkins RC, Westman EC. The effects of a low-carbohydrate ketogenic diet and a low-fat diet on mood, hunger, and other self-reported symptoms. Obesity (Silver Spring) 2007;15:182–187. [PubMed] [Google Scholar]
18. Martin CK, Rosenbaum D, Han H, Geiselman PJ, Wyatt HR, Hill JO, Brill C, Bailer B, Miller BV, 3rd, Stein R, Klein S, Foster GD. Change in food cravings, food preferences, and appetite during a low-carbohydrate and low-fat diet. Obesity (Silver Spring) 2011;19:1963–1970. [PMC free article] [PubMed] [Google Scholar]
19. Nickols-Richardson SM, Coleman MD, Volpe JJ, Hosig KW. Perceived hunger is lower and weight loss is greater in overweight premenopausal women consuming a low-carbohydrate/high-protein vs high-carbohydrate/low-fat diet. J Am Diet Assoc. 2005;105:1433–1437. [PubMed] [Google Scholar]
20. Holt SH, Delargy HJ, Lawton CL, Blundell JE. The effects of high-carbohydrate vs high-fat breakfasts on feelings of fullness and alertness, and subsequent food intake. Int J Food Sci Nutr. 1999;50:13–28. [PubMed] [Google Scholar]
21. Isaksson H, Rakha A, Andersson R, Fredriksson H, Olsson J, Aman P. Rye kernel breakfast increases satiety in the afternoon – an effect of food structure. Nutr J. 2011;10 31-2891-10-31. [PMC free article] [PubMed] [Google Scholar]
22. Astbury NM, Taylor MA, Macdonald IA. Breakfast consumption affects appetite, energy intake, and the metabolic and endocrine responses to foods consumed later in the day in male habitual breakfast eaters. J Nutr. 2011;141:1381–1389. [PubMed] [Google Scholar]
23. Gibson AA, Seimon RV, Lee CM, Ayre J, Franklin J, Markovic TP, Caterson ID, Sainsbury A. Do ketogenic diets really suppress appetite? A systematic review and meta-analysis. Obes Rev. 2015;16:64–76. [PubMed] [Google Scholar]
24. Boden G, Sargrad K, Homko C, Mozzoli M, Stein TP. Effect of a low-carbohydrate diet on appetite, blood glucose levels, and insulin resistance in obese patients with type 2 diabetes. Ann Intern Med. 2005;142:403–411. [PubMed] [Google Scholar]
25. Essah PA, Levy JR, Sistrun SN, Kelly SM, Nestler JE. Effect of macronutrient composition on postprandial peptide YY levels. J Clin Endocrinol Metab. 2007;92:4052–4055. [PubMed] [Google Scholar]
26. Bazzano LA, Hu T, Reynolds K, Yao L, Bunol C, Liu Y, Chen CS, Klag MJ, Whelton PK, He J. Effects of low-carbohydrate and low-fat diets: a randomized trial. Ann Intern Med. 2014;161:309–318. [PMC free article] [PubMed] [Google Scholar]
27. National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) Third Report of the NCEP Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation. 2002;106:3143–3421. [PubMed] [Google Scholar]
28. American Heart Association (AHA) AHA Dietary Guidelines Revision 2000: A Statement for Healthcare Professionals From the Nutrition Committee of the AHA. 2000;102:2284–2299. [PubMed] [Google Scholar]
29. Nutrition Data System for Research. The Minnesota Nutrition Data System. University of Minnesota; 2005. [Google Scholar]30. Molenberghs G, Kenward M. Missing Data in Clinical Studies. Wiley; 2007. [Google Scholar]
31. Lange T, Vansteelandt S, Bekaert M. A simple unified approach for estimating natural direct and indirect effects. Am J Epidemiol. 2012;176:190–195. [PubMed] [Google Scholar]
32. Cole SR, Hernan MA. Fallibility in estimating direct effects. Int J Epidemiol. 2002;31:163–165. [PubMed] [Google Scholar]
33. Baron RM, Kenny DA. The moderator-mediator variable distinction in social psychological research: conceptual, strategic, and statistical considerations. J Pers Soc Psychol. 1986;51:1173–1182. [PubMed] [Google Scholar]
34. Beasley JM, Ange BA, Anderson CA, Miller ER, 3rd, Erlinger TP, Holbrook JT, Sacks FM, Appel LJ. Associations between macronutrient intake and self-reported appetite and fasting levels of appetite hormones: results from the Optimal Macronutrient Intake Trial to Prevent Heart Disease. Am J Epidemiol. 2009;169:893–900. [PMC free article] [PubMed] [Google Scholar]



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย