本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
最新研究顯示,低碳水化合物、生酮飲食對2型糖尿病患者有顯著幫助。在16週的試驗中,21名患者透過此飲食計劃,血紅蛋白A1c平均降低16%,部分患者甚至能減少或停用糖尿病藥物。該飲食方案同時也對減重和降低甘油三酯水平有正面效果。
低碳水化合物,生酮飲食治療2型糖尿病
A low-carbohydrate, ketogenic diet to treat type 2 diabetes
William S Yancy, Jr,corresponding author1,2 Marjorie Foy,1 Allison M Chalecki,1 Mary C Vernon,3 and Eric C Westman2
Nutr Metab (Lond). 2005; 2: 34.
Published online 2005 Dec 1. doi: 10.1186/1743-7075-2-34
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1325029/
摘要
背景
低碳水化合物,生酮飲食(LCKD)可能對於改善糖尿病患者的血糖控制及減少藥物使用量有效。
方法
我們從門診中招募了28名體重過重的2型糖尿病患者,進行為期16周的單臂飲食干預試驗。我們提供LCKD諮詢,最初的目標是<20克碳水化合物/天,同時在飲食開始時減少糖尿病藥物的劑量。參與者每隔一周返回進行測量、諮詢及進一步的藥物調整。主要的結果是血紅蛋白A1c。
結果
註冊的28名參與者中有21名完成了研究。20名參與者是男性;13名是白人,8名是非裔美國人。平均[± SD]年齡是56.0 ± 7.9歲,BMI是42.2 ± 5.8 kg/m^2。從基線到第16周,血紅蛋白A1c從7.5 ± 1.4%降低了16%,到6.3 ± 1.0%(p < 0.001)。7名參與者停止使用糖尿病藥物,10名參與者減少藥物,4名參與者藥物不變。平均體重從131.4 ± 18.3 kg降低了6.6%,至122.7 ± 18.9 kg(p < 0.001)。在線性回歸分析中,16周的體重變化並未預測血紅蛋白A1c的變化。空腹血清甘油三酯從2.69 ± 2.87 mmol/L減少42%,至1.57 ± 1.38 mmol/L(p = 0.001),而其他血清脂質測量並未顯著變化。
結論
LCKD改善了2型糖尿病患者的血糖控制,以致大多數參與者減少或停用糖尿病藥物。由於LCKD在降低血糖方面可能非常有效,因此使用此飲食的糖尿病藥物患者應在密切的醫療監督下或能夠調整他們的藥物。
Abstract
Background
The low-carbohydrate, ketogenic diet (LCKD) may be effective for improving glycemia and reducing medications in patients with type 2 diabetes.
Methods
From an outpatient clinic, we recruited 28 overweight participants with type 2 diabetes for a 16-week single-arm pilot diet intervention trial. We provided LCKD counseling, with an initial goal of <20 g carbohydrate/day, while reducing diabetes medication dosages at diet initiation. Participants returned every other week for measurements, counseling, and further medication adjustment. The primary outcome was hemoglobin A1c.
Results
Twenty-one of the 28 participants who were enrolled completed the study. Twenty participants were men; 13 were White, 8 were African-American. The mean [± SD] age was 56.0 ± 7.9 years and BMI was 42.2 ± 5.8 kg/m2. Hemoglobin A1c decreased by 16% from 7.5 ± 1.4% to 6.3 ± 1.0% (p < 0.001) from baseline to week 16. Diabetes medications were discontinued in 7 participants, reduced in 10 participants, and unchanged in 4 participants. The mean body weight decreased by 6.6% from 131.4 ± 18.3 kg to 122.7 ± 18.9 kg (p < 0.001). In linear regression analyses, weight change at 16 weeks did not predict change in hemoglobin A1c. Fasting serum triglyceride decreased 42% from 2.69 ± 2.87 mmol/L to 1.57 ± 1.38 mmol/L (p = 0.001) while other serum lipid measurements did not change significantly.
Conclusion
The LCKD improved glycemic control in patients with type 2 diabetes such that diabetes medications were discontinued or reduced in most participants. Because the LCKD can be very effective at lowering blood glucose, patients on diabetes medication who use this diet should be under close medical supervision or capable of adjusting their medication.
背景
在1920年代之前,外源性胰島素用於治療糖尿病之前,治療的主要手段是飲食調整。那個時代的飲食建議旨在控制血糖(實際上是尿糖),與目前針對糖尿病患者的低脂、高碳水化合物的飲食建議截然不同[1,2]。例如,1923年的Dr. Elliot Joslin糖尿病飲食由”肉、家禽、野味、魚、清湯、明膠、雞蛋、黃油、橄欖油、咖啡、茶”組成,大約含有5%的能量來自碳水化合物,20%來自蛋白質,和75%來自脂肪[3]。同一時代的Dr. Frederick Allen也提倡了類似的飲食[4]。
最近,有四項研究重新審查了碳水化合物限制對2型糖尿病的影響。其中一項門診研究招募了54名2型糖尿病患者(總共132名參與者),發現在一年內低碳水化合物飲食相比於低脂、限制熱量的飲食,血紅蛋白A1c有更大的改善[5,6]。另一項研究招募了8名2型糖尿病的男性,進行了為期5周的門診餵飼交叉研究,測試了類似的飲食[7]。參與者在低碳水化合物飲食期間的糖化血紅蛋白改善程度超過了等熱量低脂飲食。第三項研究是一項10名2型糖尿病患者的住院餵飼研究[8]。僅僅14天後,血紅蛋白A1c從7.3%改善到6.8%。在第四項研究中,16名遵循20%碳水化合物飲食的2型糖尿病患者在24周內,血紅蛋白A1c從8.0%改善到6.6% [9]。只有後三項研究將血糖控制作為目標,其中兩項是密切監控的效能研究,研究期間為參與者提供了所有食物[7,8]。三項研究[6,8,9]提到了糖尿病藥物的調整,但只有一項提供了關於這些調整的詳細信息[9]。對於那些開始低碳水化合物飲食的糖尿病藥物患者,這些信息是至關重要的,因為有潛在的低血糖引起的不良效果的風險。
本研究的目的是評估在16週內,低碳水化合物、生酮飲食(LCKD)對超重和肥胖的2型糖尿病患者的影響。具體來說,我們希望了解這種飲食對門診患者的血糖和糖尿病藥物使用的影響,這些患者自行準備(或購買)自己的飲食。在之前的一篇文章中,我們報告了7名受試者的結果[10];本報告包括了這7名受試者的數據,以及後來新增參與者的數據。
方法
受試者
受試者從杜蘭姆退伍軍人事務醫療中心(VAMC)門診部招募。納入標準為年齡在35至75歲之間;體重指數(BMI)>25 kg/m2;空腹血清葡萄糖>125 mg/dL或糖化血紅蛋白(HbA1c)>6.5%,且不使用藥物,或者使用口服降糖藥物(OHA)和/或胰島素治療。排除標準為有腎功能不全、肝臟疾病或心血管疾病不穩定的證據,通過病史、體檢和實驗室檢查進行判斷。所有參與者都提供了經機構審查委員會批准的書面知情同意書。未提供任何金錢獎勵。
介入
在第一次就診時,參與者被告知如何個人或小組遵循低碳水化合物、生酮飲食(LCKD),初始目標是每天攝入≤20 g碳水化合物。參與者被教導可以食用的特定類型和數量的食物,以及應該避免的食物。最初,參與者可以無限量地攝取肉類、家禽、魚類、貝類和雞蛋;每天2杯沙拉蔬菜;每天1杯低碳水化合物蔬菜;4盎司硬質乳酪;以及有限的奶油、鱷梨、橄欖和檸檬汁。除了需要限制反式脂肪攝入外,脂肪和油脂不受限制。參與者提供了一份3頁的宣傳單和手冊[11],詳細說明了這些建議。參與者按照這些建議準備或購買他們所有的餐飲和小吃。
此外,在飲食開始的那天,糖尿病藥物被減少 – 通常是胰島素劑量減半,磺脲類劑量減半或停用。由於飲食開始後可能會出現利尿作用,如果利尿劑劑量較低(最多25毫克氫氯噻嗪或20毫克速尿),則停用利尿劑;如果劑量較高,則減半。參與者還被指示每天服用標準多種維生素,每天飲用6-8杯水,並鼓勵每週至少進行3次30分鐘的有氧運動。
參與者每隔一周回診一次,進行16周的進一步飲食諮詢和藥物調整。當參與者接近一半的減重目標或出現飢餓感時,建議他們每週增加約5克碳水化合物攝入量,只要減重持續進行。參與者每週可以從以下食物中選擇5克碳水化合物份量:沙拉蔬菜、低碳水化合物蔬菜、硬質或軟質乳酪、堅果或低碳水化合物小吃。糖尿病藥物的調整是基於每天兩次的血糖計讀數和低血糖發作,而利尿劑和其他降壓藥物的調整則是基於直立性症狀、血壓和下肢水腫。
測量
參與者在研究的基線和第2、8和16週完成了外帶食物記錄(連續4天,包括一個週末)。參與者獲得了如何完成記錄的示例手冊。一位註冊營養師使用營養軟件程序(Food Processor SQL,ESHA Research,Inc.,Salem,OR)分析了食物記錄。
以下測量每隔一周進行一次:人體測量和生命體徵測量;尿液檢測酮體;以及低血糖發作和其他症狀性副作用的評估。在參與者穿著輕便衣物並脫鞋的情況下,使用標準化數字秤測量體重。測量皮褶厚度的4個部位 – 在每個部位進行2次測量的平均值被輸入到方程式中計算百分比體脂[12]。腰圍是使用不彈性的卷尺在下肋和髂骨峰中點處測量的;分析中對2次測量取平均值。參與者在靜坐不講話的狀態下坐著3分鐘後,測量血壓和心率。經過認證的實驗室技術人員從新鮮樣本中使用以下半定量刻度評估尿酮:無、微量(最高0.9毫摩爾/升 [5毫克/分升]),小量(0.9–6.9毫摩爾/升 [5–40毫克/分升]),中量(6.9–13.8毫摩爾/升 [40–80毫克/分升]),大量(13.8–27.5毫摩爾/升 [80–160毫克/分升]),大量160(>27.5毫摩爾/升 [160毫克/分升])。低血糖發作和症狀性副作用通過對參與者進行直接提問和自行填寫的問卷進行評估。
於參與者過夜禁食後,在第0、8和16週獲取血樣本。以下的血清測試在醫院實驗室使用標準化方法進行:完整血液計數、化學指數、脂質指數、甲狀腺刺激素以及尿酸。同時,在第4和12週也進行了非禁食樣本的採集,以監測電解質和腎功能。
主要的結果是從基線到第16週的血紅素A1c的變化。所有變數的變化通過配對t檢驗或Wilcoxon符號秩檢驗進行分析,具體取決於情況。使用線性回歸分析來檢查血紅素A1c變化的預測因素。0.05或更小的p值被視為統計上的顯著性。統計分析使用SAS 8.02版本(SAS Institute,Cary,NC)進行。
結果
在這項研究中,共有28名參與者報名參加,其中21名完成了為期16週的追蹤。退出研究的原因包括無法遵循研究會議和無法堅持飲食;沒有參與者報告因介入措施相關的不良影響而退出。21名參與者中除一人外皆為男性;62%(n = 13)為白人,38%(n = 8)為非裔美國人(表1)。平均年齡為56.0 ± 7.9歲。
表格1
每個時間點都有一部分參與者提供了足夠的食物記錄供分析(表2)。參與者平均在2.5個時間點完成了食物記錄,中位數為3個時間點。總體而言,在將基線與隨後的時間點進行比較時,平均碳水化合物攝入量顯著減少,能量攝入量適度減少,而蛋白質和脂肪攝入量保持相對穩定。
表格2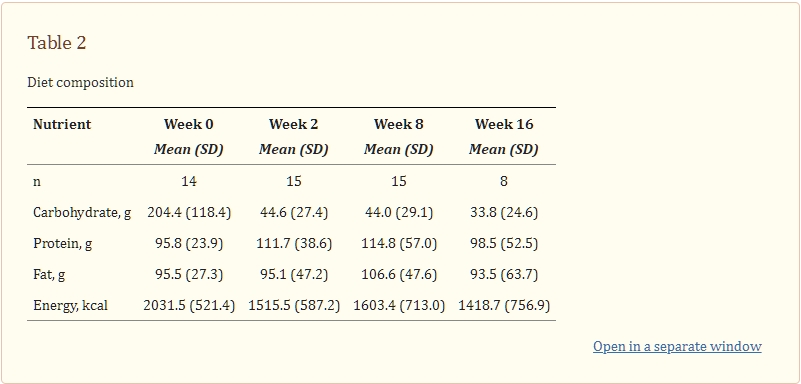
從基線到第16週,平均體重從131.4 ± 18.3 kg顯著降至122.7 ± 18.9 kg,BMI從42.2 ± 5.8 kg/m2降至39.4 ± 6.0 kg/m2,腰圍從130.0 ± 10.5 cm降至123.3 ± 11.3 cm(表3)。體重的百分比變化為-6.6%。平均體脂肪百分比從40.4 ± 5.8%降至37.0 ± 6.0%。 16週內,收縮壓和舒張壓未顯著改變。平均心率從81.2 ± 12.9次/分鐘降至74.6 ± 14.0次/分鐘(p = 0.01)。
表格3

“傳奇:TSH = 甲狀腺刺激素,HDL-C = 高密度脂蛋白膽固醇,LDL-C = 低密度脂蛋白膽固醇。
透過成對 t 檢驗或 Wilcoxon 符號秩檢驗。
† 血清鈣、TSH、總膽固醇、三酸甘油酯和 HDL-C 的結果基於 20 名參與者,因為有一名參與者在基線時未進行這些測試。尿酸基於 19 名參與者。LDL-C 基於 17 名參與者,因為基線時三酸甘油酯水平過高,無法計算 3 名參與者的 LDL-C。”
主要結果血紅素A1c從基線的7.5±1.4%降至第16週的6.3±1.0%(p < 0.001),絕對下降1.2%,相對下降16%(表格4)。除兩名參與者外(n = 19 或 90%),其餘皆出現血紅素A1c下降(圖1)。血紅素A1c的絕對下降在11名參與者中至少為1.0%(52%)。從基線開始,血紅素A1c的相對下降在14名參與者中超過10%(67%),在6名參與者中超過20%(29%)。在回歸分析中,血紅素A1c的變化與16週時體重變化、腰圍變化或體脂百分比變化無關(所有p > 0.05)。
圖1每位參與者的血紅素A1c。*紅線為群體平均值。P值表示相對於基線的平均變化。
在大多數參與者中(表格5),糖尿病藥物被停用或減少,進而改善了血糖控制。在研究期間,高血壓和高脂血症藥物劑量沒有相對於基線增加,也沒有新增新的藥物,除了3個人。與飲食相關的嚴重不良效應並未發生。其中一名參與者在漏食一餐後出現低血糖症狀,需要緊急服務的幫助,但症狀被中止,無需送往急診室或住院。
表格4

討論
在這項為期4個月的單臂飲食干預中,低碳水化合物飲食(LCKD)使2型糖尿病患者的血糖狀況得到顯著改善,這是通過空腹血糖和血紅素A1c的測量來衡量的。更重要的是,在21名參與者中,有17人的糖尿病藥物被減少或停用,其餘4人的藥物劑量保持不變的情況下,觀察到了這種改善。參與者還在體重、腰圍和體脂百分比方面都有所減少,但這些改善是適度的,並且在回歸分析中無法預測血紅素A1c的變化。
幾項最近的研究表明,低碳水化合物飲食在改善血糖狀況方面是有效的。少數研究表明,在非糖尿病患者中,低碳水化合物飲食在改善空腹血清葡萄糖[13,14]和胰島素[6,14-16]方面比高碳水化合物飲食更為有效,並且通過家庭ostasis模型測量改善胰島素敏感性[6]。其中一項研究也包括了糖尿病患者,並且注意到在6個月(低脂飲食:0.0±1.0%; 低碳水化合物飲食:-0.6±1.2%,p = 0.06)和12個月(低脂飲食:-0.1±1.6%; 低碳水化合物飲食:-0.7±1.0%,p = 0.019)的時間內,血紅素A1c有較好的改善[5]。在一項為期5週的交叉灌食研究中,8名2型糖尿病男性在低碳水化合物飲食下,其空腹血糖、24小時血糖曲線下面積(AUC)、24小時胰島素AUC和糖化血紅蛋白均有較大的改善,而在等熱量低脂飲食下則較少[7]。在為期14天的住院灌食研究中,10名2型糖尿病參與者在等血糖高胰島素性夾緊法測量的血紅素A1c和胰島素敏感性方面都有改善[8]。在一項為期24週的門診研究中,16名參與者遵循20%碳水化合物飲食,血紅素A1c也有改善[9]。
與我們的結果類似,有三項研究注意到一些參與者的糖尿病藥物有所減少[6,8,9],儘管只有一項研究提供了詳細信息。在飲食開始時,我們還停用了利尿藥物,因為擔心飲食可能帶來額外的利尿作用。這種擔憂是基於該飲食的理論效應[17],生物電阻抗對飲食對體內水分的觀察效應[18],以及對飲食的實際經驗[19]。在我們更多了解使用低碳水化合物飲食之前,對於服用糖尿病或利尿藥物的患者,醫學監測低血糖、脫水和電解質異常是至關重要的。
雖然這21名糖尿病患者的體重減少了顯著(-8.5公斤),但平均體重減少與我們之前一項試驗中低碳水化合物飲食(LCKD)參與者(-12.0公斤)相比較少[18]。考慮到糖尿病患者的基線平均體重比我們之前試驗中的LCKD參與者更高(131公斤對97公斤),這導致了體重變化百分比的巨大差異(-6.6%對-12.9%)。這種較小的體重減少可能是由幾個因素導致的。首先,在當前的研究中,大多數參與者正在服用已知會增加體重的胰島素和/或口服降糖藥物[20,21]。其次,這些相同的藥物,尤其是胰島素,會抑制酮症,在LCKD的早期階段這是追求的目標;儘管酮體是否實際上在LCKD的減重中發揮作用尚不清楚,但以前的非糖尿病患者研究已經顯示酮尿水平與減重成功之間存在正相關[22]。最後,與我們之前的研究相比,目前研究中的參與者有更多的共病疾病、較低的社會經濟地位以及更短的隨訪時間(16週對比24週),所有這些都與任何減重計劃的成功減少相關[23]。
我們研究的主要限制包括樣本數較少、持續時間較短以及缺乏對照組。然而,儘管樣本數較少且隨訪時間較短,主要結果血紅素A1c的顯著改善,說明了低碳水化合物飲食(LCKD)對血糖的戲劇性和一致性影響。然而,對於其他效應,例如血清低密度脂蛋白(LDL)和高密度脂蛋白(HDL)膽固醇的上升,樣本數較少可能是未達到統計顯著性的原因。未來需要更大樣本且包含對照組的研究,以更好地回答有關LCKD對2型糖尿病患者血清脂質影響的問題。
This is a simple headline
Lorem ipsum dolor sit amet, consectetuer adipiscing elit, sed diam nonummy nibh euismod tincidunt ut laoreet dolore magna aliquam erat volutpat.
作者貢獻
WY構思、設計並協調研究;參與數據收集;進行統計分析;起草手稿。MF協助研究設計,進行數據收集,並協助起草手稿。AC分析飲食記錄。MV協助研究/干預設計和安全監測。EW參與研究的構思和設計,並協助統計分析。所有作者都閱讀並批准了最終手稿。
前往
致謝
Yancy博士得到了退伍軍人事務健康服務研究職業發展獎(RCD 02-183-1)的支持。



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย