本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
最新研究發現,代謝相關脂肪肝病(MAFLD)與冠狀動脈粥樣硬化(CAS)存在顯著相關性。研究涉及1330名患者,顯示MAFLD患者更可能出現冠狀動脈狹窄和多發性病變,尤其是非鈣化和混合型斑塊。這項發現為理解MAFLD與心血管疾病之間的關聯提供了新見解。
代謝相關脂肪肝病與冠狀動脈斑塊模式相關性的臨床研究
A clinical study of the correlation between metabolic-associated fatty liver disease and coronary plaque pattern
Zhang, Z., Zheng, M., Lei, H. et al. A clinical study of the correlation between metabolic-associated fatty liver disease and coronary plaque pattern. Sci Rep 13, 7224 (2023).
https://doi.org/10.1038/s41598-023-34462-8
摘要
非酒精性脂肪肝病(NAFLD)是代謝綜合症(MetS)的肝臟表現,已與冠狀動脈粥樣硬化(CAS)相關。自2020年NAFLD被重新命名為代謝相關脂肪肝病(MAFLD)以來,尚未有研究評估MAFLD與CAS的關係。本研究的目的是評估MAFLD與CAS的關係。共有1330名病患作為常規身體檢查的一部分接受連續冠狀動脈電腦斷層掃描血管造影(CCTA)和腹部超音波。利用超音波來評估脂肪肝,使用CCTA來評估冠狀動脈斑塊,狹窄程度,和病變血管。以斑塊類型和狹窄程度作為依變數,MAFLD和傳統心血管風險因素作為自變數進行單因素和多因素Logistic迴歸分析,以分析MAFLD與CAS的關係。在1164名病患中,680名(58.4%)透過超音波和輔助檢查被診斷為MAFLD。與非MAFLD組相比,MAFLD組的心血管風險因素更多,MAFLD組更可能有冠狀動脈粥樣硬化,冠狀動脈狹窄和多發冠狀動脈狹窄。在單因素logistic迴歸中,MAFLD與總斑塊、鈣化斑塊、非鈣化斑塊、混合斑塊以及冠狀動脈顯著狹窄顯著相關。(p < 0.05)。調整心血管風險因素後,MAFLD與非鈣化斑塊(1.67;95%信賴區間(CI) 1.15–2.43;p = 0.007)和混合斑塊(1.54;95% CI 1.10–2.16;p = 0.011)相關。在這個研究中,MAFLD組的心血管風險因素更多,MAFLD與冠狀動脈粥樣硬化和顯著狹窄相關。進一步的研究發現MAFLD與非鈣化斑塊和混合斑塊之間存在獨立的關聯,這提示MAFLD與冠狀動脈粥樣硬化之間存在臨床相關的連結。
引言
隨著生活水準的提高,代謝症候群(MetS,包括肥胖症和2型糖尿病)的發病率逐年增加。曾被稱為非酒精性脂肪性肝病(NAFLD)的代謝相關脂肪肝病(MAFLD)是慢性肝病的主要原因。在2018年,中國的NAFLD患病率為32.9%1,到2030年,中國的NAFLD患者總數預計將增加到314.58億人,這將是全球NAFLD患病率增加最快的國家。NAFLD的肝臟併發症包括非酒精性脂肪肝炎(NASH)、肝硬化和肝細胞癌。雖然NAFLD患者中有10-25%的人併發NASH,這可能導致肝硬化、肝細胞癌和肝功能衰竭2,但NAFLD患者的主要死因是心血管疾病(CVD)3。在NAFLD患者中,通常存在各種心血管風險因素,如高血壓、糖尿病、肥胖症和MetS。NAFLD與動脈硬化(AS)密切相關4,並且可能與CVD有相同的病因。
2020年,來自22個國家的國際專家小組提出了NAFLD的新定義5,並將此疾病重新命名為MAFLD。MAFLD的診斷標準基於在代謝異常患者(與酒精消耗或如慢性病毒性肝炎等共病無關)中證實的肝脂肪變性。然而,並非所有NAFLD患者都可以被診斷為MAFLD,反之亦然,兩者不可以互換(kappa係數為0.92)6。自從將NAFLD重新命名為MAFLD以來,研究揭示,MAFLD與CVD的相關性強於NAFLD與CVD之間的相關性7,8。我們進行了這項回顧性橫斷面研究,以闡明MAFLD與CAS之間的關係。
方法
本研究回顧性地包括了於2021年1月至2022年1月期間在昆明醫科大學第二附屬醫院進行冠狀動脈電腦斷層掃描血管造影(CCTA)和腹部超聲檢查的患者。排除標準如下:(1)年齡小於18歲或大於80歲的患者;(2)已出院或確診為惡性腫瘤的患者;(3)進行過冠狀動脈支架植入或冠狀動脈搭橋手術的患者;及(4)在醫院死亡的患者。根據MAFLD的診斷標準,研究人群被劃分為MAFLD組和非MAFLD組。MAFLD的診斷標準基於組織學、影像學或血液生物標記物證據顯示肝脂肪堆積(肝脂肪變性),並符合以下三項標準之一:超重/肥胖 [體重指數(BMI)> 23 kg/m2],2型糖尿病,或存在代謝功能障礙的證據。代謝功能障礙的定義是存在以下至少兩種代謝異常的風險因素:(1)男性腰圍≥90厘米,女性腰圍≥80厘米;(2)血壓(BP)≥130/85毫米汞柱或接受特定藥物治療;(3)血漿三酰甘油≥1.70毫摩爾/升或接受特定藥物治療;(4)男性血漿高密度脂蛋白膽固醇(HDL-C)<1.0毫摩爾/升,女性<1.3毫摩爾/升或接受特定藥物治療;(5)血糖異常,即空腹血糖(FBG),5.6–6.9毫摩爾/升;飯後2小時血糖(PBG),7.8–11.0毫摩爾/升;或糖化血紅蛋白(HbA1c),5.7–6.4%;(6)穩態胰島素抗藥性指數≥2.5;及(7)血漿高敏C反應蛋白(CRP)>2毫克/升5。總共有1164名患者被納入研究(圖1)。這項涉及人類參與者的回顧性研究符合昆明醫科大學第二附屬醫院倫理委員會的倫理標準,並符合1964年(赫爾辛基宣言)及其後續修訂。昆明醫科大學第二附屬醫院的倫理委員會已放棄需要獲得知情同意。
Abstract
Nonalcoholic fatty liver disease (NAFLD) is the hepatic manifestation of metabolic syndrome (MetS) and has been correlated with coronary atherosclerosis (CAS). Since NAFLD was renamed metabolic-associated fatty liver disease(MAFLD) in 2020, no studies have evaluated the correlation between MAFLD and CAS. The aim of this study was to evaluate the relationship between MAFLD and CAS. A total of 1330 patients underwent continuous coronary computed tomography angiography (CCTA) and abdominal ultrasound as part of a routine physical examination. Ultrasonography was used to assess fatty liver, and CCTA was used to assess coronary artery plaques, degree of stenosis, and diseased blood vessels. Univariate and multivariate logistic regression analyses were performed with plaque type and degree of stenosis as dependent variables and MAFLD and traditional cardiovascular risk factors as independent variables to analyze the correlation between MAFLD and CAS. Among the 1164 patients, 680 (58.4%) were diagnosed with MAFLD through a combination of ultrasound and auxiliary examinations. Compared with the non-MAFLD group, the MAFLD group had more cardiovascular risk factors,and the MAFLD group had more likely to have coronary atherosclerosis, coronary stenosis and multiple coronary artery stenosis.In the univariate logistic regression, MAFLD was significantly correlated with overall plaque, calcified plaques, noncalcified plaques, mixed plaques,and significant stenosis in the coronary arteries.(p < 0.05). After adjusting for cardiovascular risk factors , MAFLD was correlated with noncalcified plaques (1.67; 95% confidence interval (CI) 1.15–2.43; p = 0.007) and mixed plaques (1.54; 95% CI 1.10–2.16; p = 0.011). In this study, MAFLD group had more cardiovascular risk factors, MAFLD was correlated with coronary atherosclerosis,and significant stenosis.Further study found independent associations between MAFLD and noncalcified plaques and mixed plaques, which suggest a clinically relevant link between MAFLD and coronary atherosclerosis.
Introduction
As living standards have improved, the incidence of metabolic syndrome (MetS, including obesity and type 2 diabetes) is increasing annually. Metabolic-associated fatty liver disease (MAFLD), once known as nonalcoholic fatty liver disease (NAFLD), is the main cause of chronic liver disease. The prevalence of NAFLD in China was 32.9% in 20181, and by 2030 the total number of NAFLD patients in China is expected to increase to 314.58 million, which would be the fastest increase in the prevalence of NAFLD in the world. Liver complications of NAFLD include nonalcoholic steatohepatitis (NASH), liver cirrhosis, and hepatocellular carcinoma. Although NAFLD is complicated with NASH in 10–25% of NAFLD patients, which can lead to liver cirrhosis, hepatocellular carcinoma and liver failure2, the main cause of death in NAFLD patients is cardiovascular disease (CVD)3. A variety of cardiovascular risk factors, such as hypertension, diabetes, obesity, and MetS, are usually present in NAFLD patients. NAFLD is closely correlated with atherosclerosis (AS)4, and it may have the same pathogenesis as CVD.
In 2020, an international panel of experts from 22 countries proposed a new definition of NAFLD5 and renamed this disease MAFLD. The diagnostic criteria for MAFLD are based on evidence of liver steatosis in patients with metabolic abnormalities (not related to alcohol consumption or the presence of comorbidities such as chronic viral hepatitis). However, because not all patients with NAFLD can be diagnosed with MAFLD and vice versa, the two terms are not interchangeable (kappa coefficient is 0.92)6. Since the renaming of NAFLD as MAFLD, studies have revealed that the correlation between MAFLD and CVD is stronger than that between NAFLD and CVD7,8. We conducted this retrospective cross-sectional study was conducted to clarify the relationship between MAFLD and CAS.
Methods
This study retrospectively included patients who underwent both coronary computed tomography angiography (CCTA) and abdominal ultrasound during their stay at the Second Affiliated Hospital of Kunming Medical University from January 2021 to January 2022. The exclusion criteria were as follows: (1) patients aged < 18 or > 80 years; (2) patients who had been discharged from the hospital or had a clear diagnosis of malignant tumors; (3) patients who had undergone coronary stent implantation or coronary artery bypass grafting; and (4) patients who died in the hospital. The study population was divided into an MAFLD group and a non-MAFLD group using the diagnostic criteria for MAFLD. The diagnostic criteria for MAFLD are based on histology, imaging or blood biomarker evidence of fat accumulation in the liver (hepatic steatosis) and one of the following three criteria: overweight/obesity [body mass index (BMI) > 23 kg/m2], type 2 diabetes mellitus (T2DM), or evidence of metabolic dysfunction. Metabolic dysfunction was defined as the presence of at least two of the following risk factors for metabolic abnormalities: (1) waist circumference ≥ 90 cm in men and ≥ 80 cm in women; (2) blood pressure (BP) ≥ 130/85 mmHg or receiving specific drug treatment; (3) plasma triacylglycerol ≥ 1.70 mmol/L or receiving specific drug treatment; (4) plasma high-density lipoprotein cholesterol (HDL-C) < 1.0 mmol/L in males and < 1.3 mmol/L in females or receiving specific drug treatment; (5) prediabetes, i.e., fasting blood glucose (FBG), 5.6–6.9 mmol/L; 2-h postprandial blood glucose (PBG), 7.8–11.0 mmol/L; or glycosylated hemoglobin (HbA1c), 5.7–6.4%; (6) steady-state insulin resistance index ≥ 2.5; and (7) plasma high-sensitivity C-reactive protein (CRP) > 2 mg/L5. A total of 1164 patients were included in the study (Fig. 1). This retrospective study involving human participants met the ethical standards of the Ethics Committee of the Second Affiliated Hospital of Kunming Medical University and the 1964 (Helsingin Declaration) and its subsequent amendments.The need for informed consent was waived by the Ethics Committee of the Second Affiliated Hospital of Kunming Medical University.
圖片1臨床和實驗數據
參與者的基本人口統計數據是從昆明醫科大學第二附屬醫院的數據庫中獲得的。收集了實驗室指標、性別、年齡、BMI、用藥歷史、吸煙歷史和慢性疾病歷史(高血壓和2型糖尿病)。實驗室指標包括完全血液計數、天門冬酰胺轉移酶(AST)、丙酮酸轉氨酶(ALT)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、尿素氮、肌酐、尿酸、空腹血糖(FBG)和糖化血紅蛋白(HbA1c)。肥胖被定義為BMI ≥ 28.0 kg/m29。糖尿病被定義為FBG濃度 ≥ 126 mg/dL,自我報告的糖尿病歷史,或使用抗糖尿病藥物。高血壓被定義為BP ≥ 140/90 mmHg,自我報告的高血壓歷史或醫院入院時醫生診斷10。血脂異常被定義為血清膽固醇和/或TG的升高,俗稱高血脂症(總膽固醇(TC)≥ 5.2 mmol/L,TG ≥ 1.7 mmol/L,LDL-C ≥ 3.4 mmol/L,或HDL-C < 1.0 mmol/L)。
CCTA影像採集和分析
使用Canon Aquilion One 320片CT掃描器(解析度,1024 x 1024)進行冠狀動脈CCTA掃描。使用前瞻性心電圖(ECG)觸發採集,在RR間期的50%處以100 kV和120 mAs的參數分離出4 x 2.5 mm的層,並獲取整個冠狀動脈區域的3.0 mm層的影像。選擇一組最佳的冠狀動脈造影序列並導入工作站(CoronaryDoc,樹坤科技,北京,中國)。所有CCTA掃描均由經驗豐富的心血管放射學家進行分析。CCTA分析根據心血管計算機斷層掃描學會的指南來評估斑塊類型和冠狀動脈狹窄程度11。冠狀動脈狹窄的程度分為以下等級:輕度狹窄,1-29%;中度狹窄,30-49%;中度狹窄,50-69%;重度狹窄,70-99%;和完全阻塞,100%12。由鈣化組織佔據的斑塊區域超過50%(原始掃描中的密度 > 130 Hounsfield單位)被分類為鈣化斑塊,含有 < 50% 鈣的斑塊被分類為混合斑塊,無鈣斑塊被分類為非鈣化斑塊13。一個冠狀動脈狹窄≥50%被定義為單一病變,兩個以上血管的狹窄≥50%被定義為多重病變。
超聲檢查
利用Philips IU Elite彩色多普勒超聲系統確認脂肪肝。專業的超聲醫生對每位參與者的肝臟進行B模式超聲檢查。如果符合以下任一條件則診斷為脂肪肝:(1)肝臟近場的回聲信號增強,(2)肝內管道結構不清,和(3)肝臟遠場的回聲信號減弱14。
統計分析
連續數據以平均值±標準差(SD)表示。為了比較各組間的數據,連續變量使用獨立樣本t檢驗,類別變量使用Fisher’s精確檢驗,順序變量使用Wilcoxon秩和檢驗。為了分析MAFLD與CCTA上的冠狀動脈粥樣硬化斑塊和顯著冠狀動脈狹窄的關係,進行了單因素和多因素邏輯回歸分析。多變量模型中的協變數(年齡,性別,吸煙,BMI,高血壓,糖尿病,和LDL)根據臨床重要性和統計顯著性選擇。p值< 0.05被認為具有統計學意義。使用SPSS軟件(版本25.0)進行數據處理和統計分析。
表1:MAFLD組與非MAFLD組的基線特性。
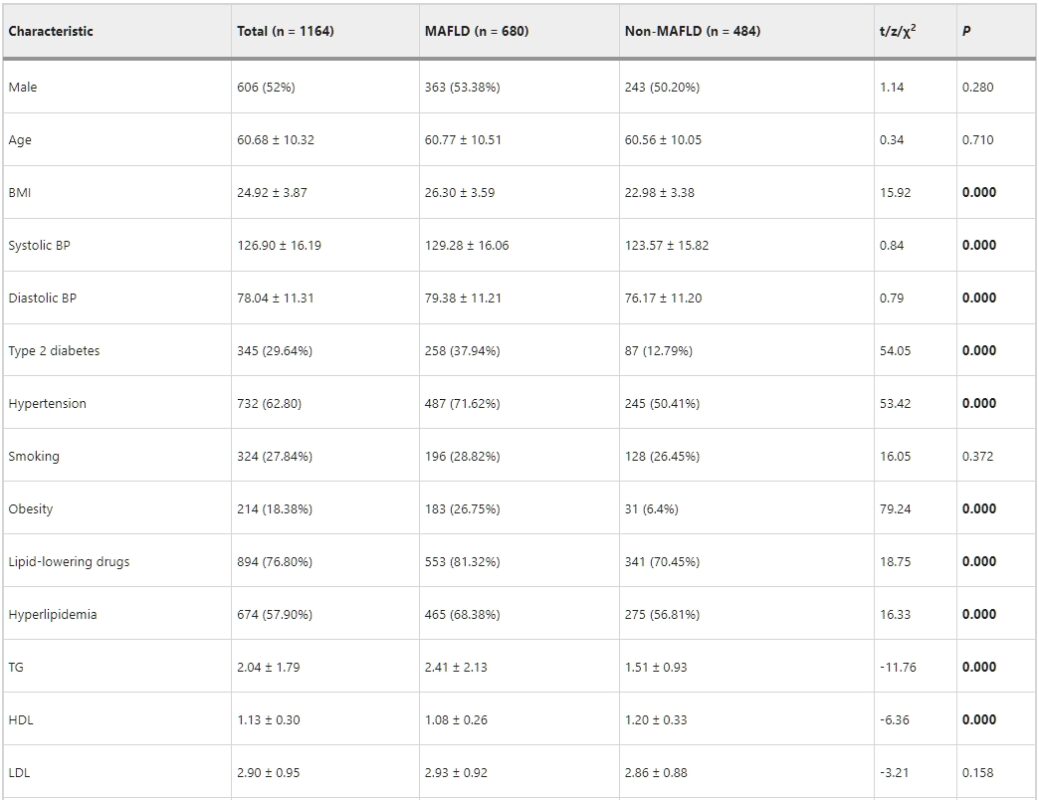
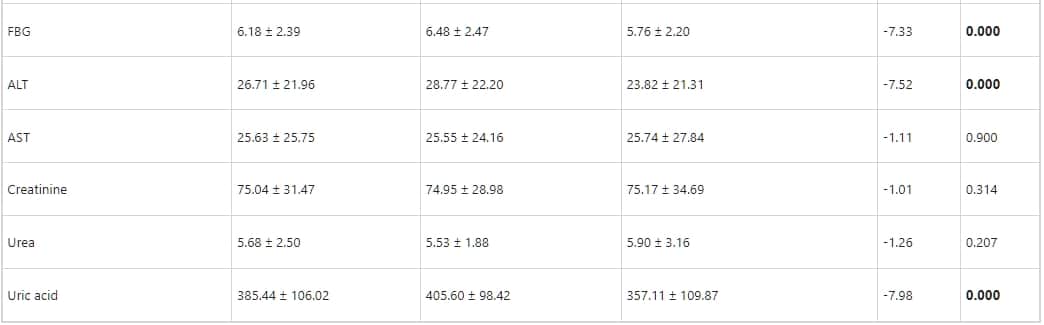
表2列出了冠狀動脈中動脈粥樣硬化斑塊的類型和嚴重程度。在1164位病人中,有992位(79.20%)發現有CAS。在MAFLD組中,81.32%的病人有CAS(定義為冠狀動脈中的任何斑塊),在非MAFLD組中,76.23%的病人有CAS;差異不具統計學意義。在病人中分別檢測到鈣化斑塊、非鈣化斑塊、和混合斑塊的頻率分別為508位(43.64%)、206位(17.70%)和286位(24.57%)。鈣化斑塊、非鈣化斑塊、和混合斑塊的患病率在MAFLD病人中分別顯著高於非MAFLD病人(p < 0.05)。共有302位病人(25.95%)有顯著的冠狀動脈狹窄(狹窄 ≥ 50%的直徑),並且MAFLD組的顯著冠狀動脈狹窄程度顯著高於非MAFLD組。在單一血管病變(一個冠狀動脈狹窄 ≥ 50%)方面,MAFLD組與非MAFLD組之間沒有顯著差異,但在MAFLD組中,多血管病變的頻率顯著高於非MAFLD組。在所有參與者中,分別在127位(10.91%)、22位(1.89%)、229位(19.67%)和76位(6.5%)參與者中觀察到右冠狀動脈、左主幹、左前降支和左迴旋冠狀動脈的顯著狹窄。
表2:MAFLD病人與非MAFLD病人的CCTA結果比較。
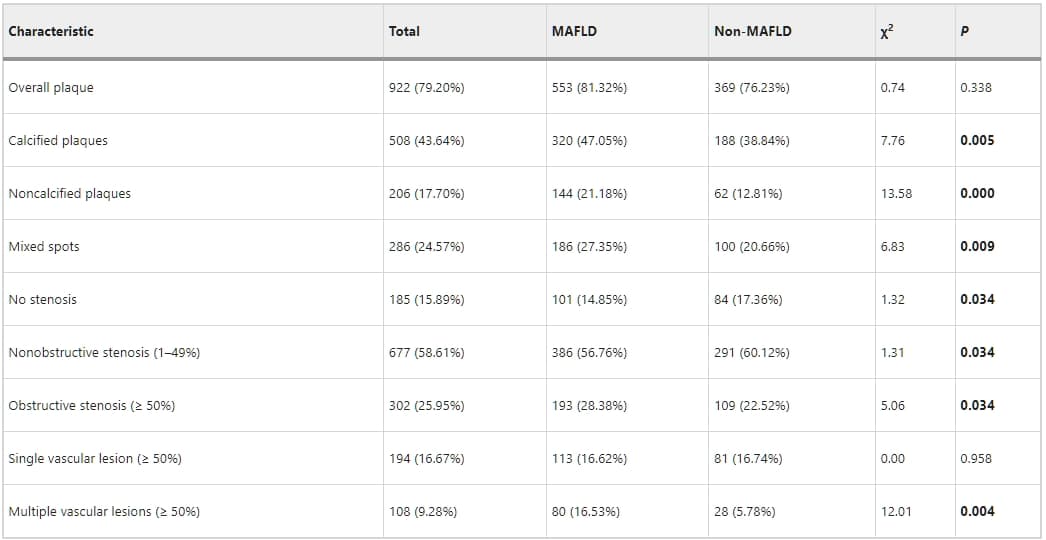
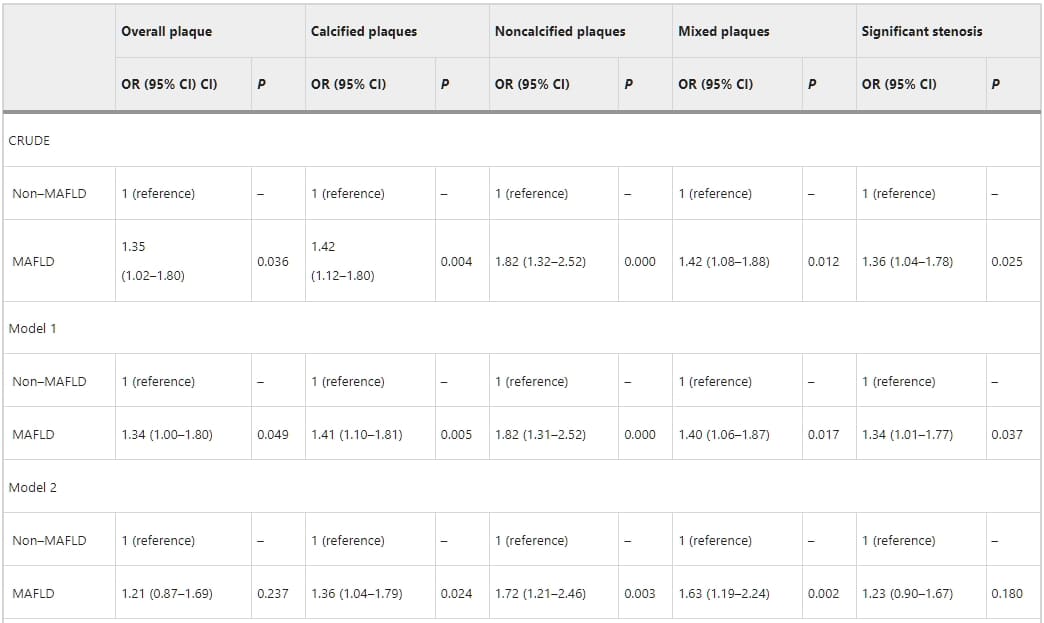
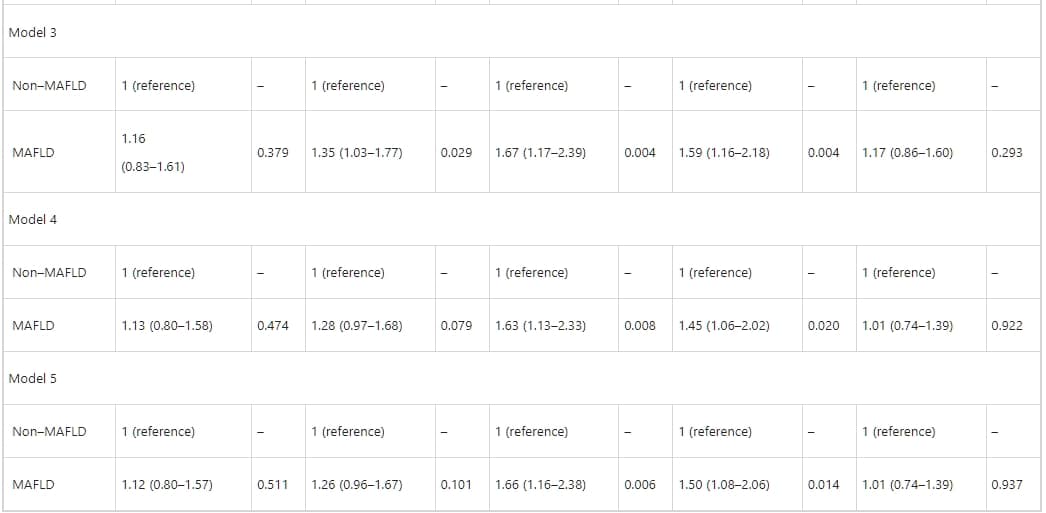
表3、4、5詳述了MAFLD與CAS的關聯性。在單變量羅吉斯迴歸中,MAFLD與冠狀動脈的總體斑塊、鈣化斑塊、非鈣化斑塊、以及混合斑塊顯著相關。MAFLD也與顯著冠狀動脈狹窄顯著相關(p < 0.05)。然而,校正心血管風險因素後(如年齡、性別、吸煙史、BMI、糖尿病、高血壓、以及高脂血症),羅吉斯迴歸分析指出MAFLD與總體斑塊(1.15,95%置信區間[CI]:0.82–1.62;p = 0.396)、鈣化斑塊(1.28,95% CI:0.97–1.69;p = 0.076)、或顯著狹窄(1.00,95% CI:0.73–1.37;p = 0.979)無關。相反地,MAFLD與非鈣化斑塊(1.64,95% CI:1.14–2.35;p = 0.007)和混合斑塊(1.46,95% CI:1.06–2.01;p = 0.020)顯著相關。
表3 單變量羅吉斯迴歸分析冠狀動脈狹窄、斑塊與MAFLD和風險因素的關係。
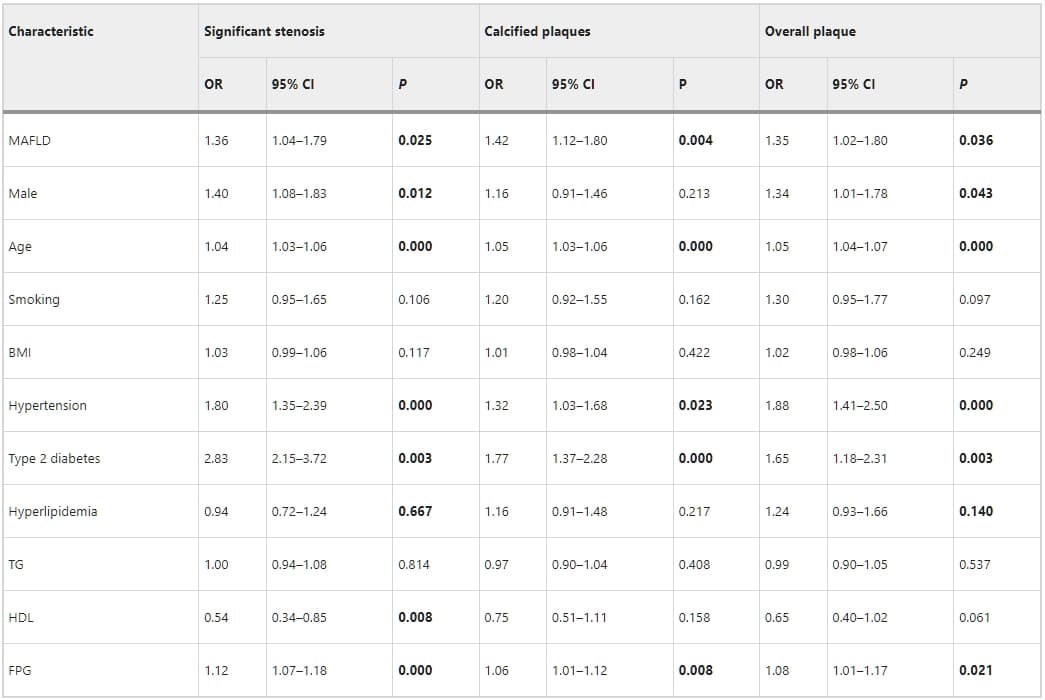
表4:單變量羅吉斯迴歸分析冠狀動脈斑塊與MAFLD和風險因素的關係。
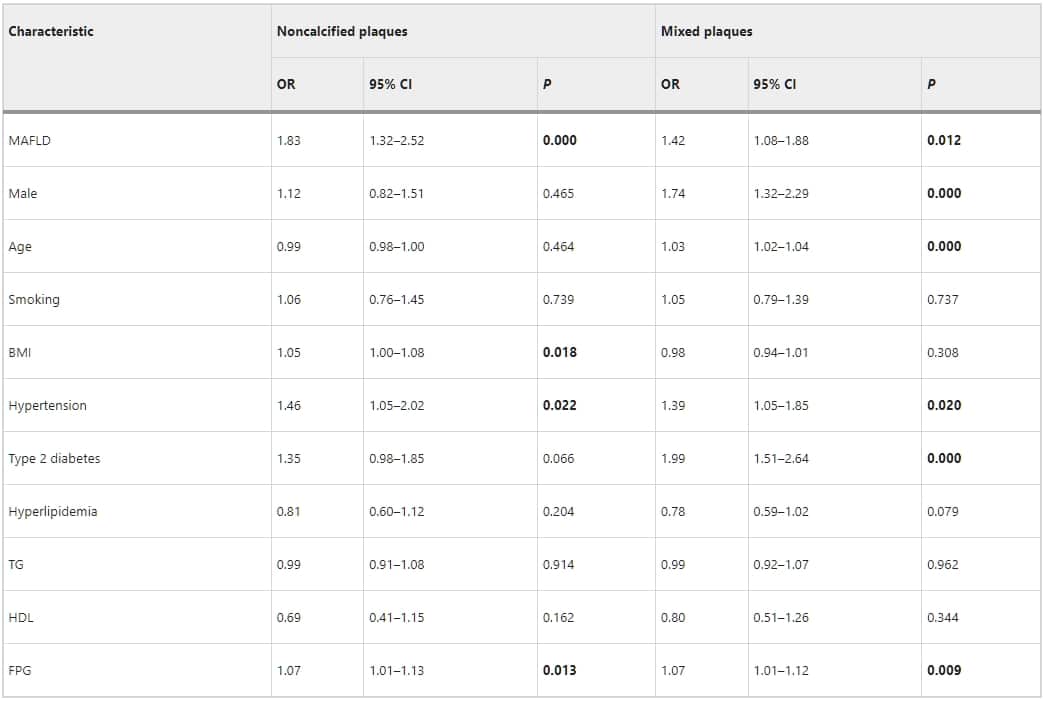
表5:多變量迴歸分析冠狀動脈狹窄和斑塊型態與MAFLD嚴重度和風險因素的關係。
討論
這項研究證實了MAFLD組具有更多的心血管風險因素,與冠狀動脈粥樣硬化性斑塊和顯著狹窄有關。此外,經過心血管風險因素的校正後,MAFLD與非鈣化斑塊和混合斑塊的數量獨立相關,表明MAFLD與CAS存在關聯。
MAFLD組具有更多的心血管風險因素,如高血壓,糖尿病,肥胖症和血脂異常,這些都是CVD的常見風險因素。以前的研究發現NAFLD與CVD相關。一項涉及17350名患者的研究15發現,NAFLD與使用佛萊明漢風險評分(FRS)估計的10年發展CVD的風險增加有關,並且與經典的CVD風險因素或MetS無關。另一項對脂肪肝患者的研究,平均隨訪6.5年,發現該組的CVD風險加倍16。由於NAFLD被重新命名為MAFLD,高血壓,糖尿病,肥胖症和血脂異常已被納入其診斷標準。因此,MAFLD與CVD之間的關係比NAFLD與CVD之間的關係更為密切。連接NAFLD和CVD的複雜機制尚未完全闡明,但炎症是一個重要的聯繫;連接MAFLD和CVD的機制必須進一步研究。
本研究發現MAFLD與冠狀動脈總體斑塊相關。在排除了冠心病的公認風險因素,如年齡,性別,高血壓,糖尿病,吸煙和高血脂等因素後,MAFLD仍然與非鈣化斑塊和混合斑塊的數量獨立相關。Niikura等人.17發現,NAFLD與頸動脈內膜-中膜厚度增加,CAS和動脈剛度增加密切相關。一項對27項研究的meta分析指出,在排除傳統的心血管風險因素和MetS後,非酒精性脂肪肝與亞臨床AS仍然獨立相關18。最新的證據表明,NAFLD是AS心血管併發症,如中風和心肌梗死的風險因素19,20,21。AS是CVD的原因之一,炎症在動脈壁內膜增厚,動脈硬化和管腔狹窄中起著重要作用22。脂肪肝患者中CRP的增加表示存在炎症過程23,但其底層機制更為複雜,可能與NAFLD中慢性脂肪超載引起的肝細胞死亡有關。肝細胞死亡導致釋放出觸發巨噬細胞活化的分子,並且巨噬細胞和庫普弗細胞的增加導致系統性炎症標記物,包括白介素-1、-6和-20亞家族在血液中的水平增加24,25。應對MAFLD患者進行動脈粥樣硬化性心血管疾病(ASCVD)的篩查。
大多數關於NAFLD和CAS的研究都建議NAFLD只與非鈣化斑塊或混合斑塊相關26,27,但這項研究的結果顯示MAFLD與非鈣化和混合斑塊均有關聯,表明MAFLD與CVD的關聯更為密切。這種更密切的關聯可能是因為MAFLD的診斷標準更好地識別出具有代謝異常的瘦或正常體重的脂肪肝患者,這是一個未被NAFLD的診斷標準識別出,但有高風險發展成CVD的人群。最近的一項研究揭示,MAFLD患者比NAFLD患者有更高的ASCVD風險28,而一項對13,083名有完整超聲和實驗室數據的患者的回顧性研究表明,符合MAFLD診斷標準的患者比NAFLD患者更可能患有多種代謝共病,包括CVD29。因此,醫生應使用MAFLD的診斷標準,在早期階段識別出有代謝功能障礙的患者,並及時進行干預,以降低CVD的發生率。
根據表2,MAFLD組有144個非鈣化斑塊,非MAFLD組有62個,混合型斑塊在MAFLD組有186個,非MAFLD組有100個。MAFLD組的非鈣化斑塊和混合型斑塊分別是非MAFLD組的2.3倍和1.86倍。一項持續3年的前瞻性研究30發現,非鈣化斑塊和混合斑塊的患者在3年內發生重大心血管事件的可能性顯著高於鈣化斑塊的患者(分別為23%,38%和6%),顯示非鈣化斑塊和混合斑塊的患者的預後情況不良。混合斑塊包含鈣化和非鈣化斑塊。非鈣化斑塊是不穩定的斑塊,不穩定的斑塊破裂會使人們更有可能發生急性冠狀動脈綜合症事件30。有MAFLD結合CAS的患者可能有較高的重大心血管事件和急性冠狀動脈綜合症事件的風險。
這項研究在MAFLD組中有顯著多的多冠狀動脈狹窄患者比非MAFLD組。多冠狀動脈狹窄可能導致更多的不良心血管事件和病人的預後不良。因此,應對MAFLD患者進行ASCVD的篩查。對CAS的患者應篩查MAFLD,以便快速改善他們的代謝功能障礙,以避免不良心血管事件。
本研究的第一個限制是它無法澄清MAFLD與冠狀動脈斑塊形成之間的因果關係。其次,由於與放射性材料(如鈣金屬)相關的圖像重建工件可能會遮擋冠狀動脈腔,這些工件可能導致對冠狀動脈狹窄的低估或高估(在高鈣條件下對血管腔的評估不準確)。第三,本研究的樣本量小,且結果保守。即使在校正了年齡、性別、吸煙、BMI、高血壓和糖尿病等本研究中認可的冠狀動脈粥樣硬化的潛在風險因素後,可能仍存在一些殘餘風險因素,且那些未被校正的剩餘潛在風險因素可能已影響研究結果。因此,我們並未有足夠的能力排除更微妙的關聯,對此需要進行更大範圍的研究。最後,由於這是一項回溯性研究,因此無法追溯開始使用特定藥物和開始使用之前的肝臟狀況的具體時間,例如降壓藥、降脂藥、降糖藥和減重藥,它們對於CVD和代謝功能障礙等疾病有較好的預防和治療效果,因此可能已導致對MAFLD和CVD實際患病率的低估。
總結來說,這項回溯性研究發現MAFLD具有更多的心血管風險因素,且MAFLD與冠狀動脈粥狀硬化以及重要狹窄有關。進一步的研究發現,MAFLD與非鈣化斑塊和混合斑塊的數量之間存在獨立的關聯,這些結果暗示了MAFLD與冠狀動脈粥狀硬化之間的臨床重要聯繫。
數據可用性
本研究中使用和/或分析的數據集可以在合理的要求下從相應的作者處獲得。
縮寫
NAFLD:非酒精性脂肪肝病
MetS:代謝綜合症
CAS:冠狀動脈粥樣硬化
MAFLD:代謝相關脂肪肝病
CCTA:冠狀動脈電腦斷層血管造影
NASH:非酒精性脂肪性肝炎
AS:動脈粥樣硬化
CVD:心血管疾病
BMI:身體質量指數
BP:血壓
TG:甘油三酯
TC:總膽固醇
HDL:高密度脂蛋白
LDL:低密度脂蛋白
FBG:空腹血糖
PBG:飯後血糖
HbA1c:糖化血紅蛋白
CRP:C反應蛋白
AST:天門冬氨酸轉氨酶
ALT:丙氨酸轉氨酶
ASCVD:動脈粥樣硬化性心血管疾病
參考資料
Zhou, J. 等。2018 年中國 NAFLD 的流行病學特徵。肝病學 71, 1851–1864 (2020)。
Allen, A. M. 等。非酒精性脂肪肝病的發生和其對代謝負擔和死亡的影響:一項 20 年的社區研究。肝病學 67, 1726–1736 (2018)。
Hagström, H. 等。纖維化階段而非 NASH 預測 NAFLD 病理證實的患者的死亡率和嚴重肝病的發展時間。肝病學期刊 67, 1265–1273 (2017)。
Park, H. E. 等。肝脂肪堆積對冠狀動脈斑塊形態學的臨床意義:控制衰減參數的評估。消化病學期刊 54, 271–280 (2019)。
Eslam, M. 等。MAFLD:對代謝相關脂肪肝病的命名的共識驅動提議。胃腸病學 158, 1999-2014.e1 (2020)。
Huang, J. 等。作者對“現實世界”數據中 MAFLD 和 NAFLD 診斷標準的符合性的回應。國際肝病雜誌 40, 2880–2881 (2020)。
Tsutsumi, T. 等。MAFLD 比 NAFLD 更好地預測動脈粥樣硬化性心血管風險的進展:廣義估計方程方法。肝病學研究 51, 1115–1128 (2021)。
Lee, H. 等。代謝功能失調相關脂肪肝病和心血管疾病風險的首次發生:全國性隊列研究。臨床胃腸病學和肝病學 19, 2138–47.e10 (2020)。
中國營養學會肥胖防治分會,中國營養學會臨床營養分會,中國預防醫學會行為健康分會等。中國肥胖防治專家共識。中華流行病學雜誌 43, 609–626 (2022)。
國內臨床指南。成人血脂異常管理中國指南。中華循環雜誌 2016(31), 937–950 (2016)。
Shaw, L. J. 等。心血管電腦斷層學會/北美心血管影像學會專家共識文件:冠狀動脈 CT 影像學對動脈粥樣斑塊的評估。心血管電腦斷層學 15, 93–109 (2020)。
Assy, N. 等。非酒精性脂肪肝病患者存在冠狀動脈斑塊。放射學 254, 393–400 (2010)。
Abbara, S. 等。心血管電腦斷層學會指南:冠狀動脈電腦斷層血管造影的進行和獲取:心血管電腦斷層學會指南委員會的報告:獲得北美心血管影像學會(NASCI)的認可。心血管電腦斷層學期刊 10(6), 435–449 (2016)。
Lee, S. S. 等。非侵入性評估肝脂肪變性:影像檢查準確性的前瞻性比較。J. Hepatol. 52, 579-585 (2010)。
Choi, S.-Y. 等. 非酒精性脂肪肝疾病與韓國人冠狀動脈心臟病風險之間的關係。美國胃腸病學雜誌 104, 1953–1960 (2009)。
Targher, G. 等. 非酒精性脂肪肝疾病與2型糖尿病患者心血管事件的發生率獨立相關。糖尿病護理 30, 2119–2121 (2007)。
Niikura, T. 等. 非酒精性肝硬化患者的冠狀動脈疾病比脂肪肝嚴重。診斷 10, 129 (2020)。
Oni, E. T. 等. 系統性審查:非酒精性脂肪肝患者的亞臨床心血管疾病負擔和嚴重程度;我們應該關心嗎?動脈粥樣硬化 230, 258–267 (2013)。
Ichikawa, K. 等. 在非酒精性脂肪肝病患者中,冠狀動脈電腦斷層掃描血管造影的預後價值。JACC心血管影像 13, 1628–1630 (2020)。
Arai, T. 等. 在經肝生檢確診的非酒精性脂肪肝病患者中,肝纖維化與頸動脈動脈粥樣硬化相關。科學報告 11, 15938 (2021)。
Ichikawa, K. 等. 非酒精性脂肪肝病對疑似冠狀動脈疾病患者冠狀動脈電腦斷層掃描血管造影結果的預後價值。歐洲預防心臟病雜誌 28, 2059–2066 (2022)。
Gaudio, E. 等. 動脈粥樣硬化病變的形態學方面:過去與現在。臨床治療 157, 135–142 (2006)。
Aengevaeren, V. L. 等. 運動與冠狀動脈動脈粥樣硬化:觀察,解釋,相關性和臨床管理。循環 141, 1338–1350 (2020)。
Krenkel, O. & Tacke, F. 肝巨噬細胞在組織穩態和疾病中的作用。自然免疫學評論 17, 306–321 (2017)。
He, Y. 等. 肝疾病中與細胞因子相關的免疫病理生物學和治療目標。細胞分子免疫學 18, 18–37 (2021)。
Lee, S. B. 等. 非酒精性脂肪肝疾病與亞臨床冠狀動脈動脈粥樣硬化之間的關聯:觀察性隊列研究。肝病學雜誌 68, 1018–1024 (2017)。
Saraya, S. 等. 冠狀動脈疾病與非酒精性脂肪肝病之間的關聯,通過電腦斷層掃描評估。埃及心臟病學期刊 73, 96 (2021)。
Lin, S. 等. 實際世界中 MAFLD 和 NAFLD 診斷標準的比較。肝臟國際 40, 2082–2089 (2020)。
Hou, Z.-H. 等. 冠狀動脈 CT 血管造影和鈣化評分對門診患者主要不良心臟事件的預後價值。JACC心血管影像 5, 990–999 (2012)。
Thomsen, C. & Abdulla, J. 高風險冠狀動脈斑塊的特徵和與其相關的預後:系統性審查和薈萃分析。歐洲心臟病學心血管影像 17, 120–129 (2016)。
作者資訊
作者與所屬機構 中國昆明市五華區滇緬大道374號,昆明醫科大學第二附屬醫院消化科,650000,中國
張志教, 鄭夢瑤, 雷宏濤, 江子猛, 陳裕航, 何海宇, 趙公方 & 黃華
貢獻
張志教:負責實施研究計畫、數據收集、數據整理與分析,並撰寫及修訂論文。鄭夢瑤:提出研究主題,設計研究計畫,並修訂論文。雷宏濤:負責數據的統計分析並修訂論文。江子猛:負責數據補充和整理。陳裕航:負責數據補充和整理。何海宇:提供修改論文的建議。黃華:參與監督、指導及論文的審查與修訂。趙公方:參與監督、指導,以及論文的審查與修訂。
通訊作者
通訊作者 Gongfang Zhao.



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย