本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
在末期腎功能衰竭患者中,心臟衰竭的標誌物BNP和NT-proBNP的水平受到腎功能影響變得模糊不清。此研究旨在探討腎功能受損對這些標誌物的影響,並確定用於診斷心室收縮功能不全的適當臨界值。結果顯示,NT-proBNP相較於BNP,在預測心衰方面更為有效,儘管兩者在腎功能受損時均會升高。
B型利尿肽對比氨基末端前B型利尿肽:在腎功能受損患者中選擇最佳心衰標記
B-type natriuretic peptide versus amino terminal pro-B type natriuretic peptide: selecting the optimal heart failure marker in patients with impaired kidney function
Lena Jafri, Waqar Kashif, Javed Tai, Imran Siddiqui, Iqbal Azam, Hira Shahzad & Farooq Ghani
BMC Nephrology volume 14, Article number: 117 (2013) Cite this article
https://bmcnephrol.biomedcentral.com/articles/10.1186/1471-2369-14-117
Abstract
Background
The effect of impaired kidney function on B-type natriuretic peptide (BNP) and N-terminal proBNP (NT-proBNP) is vague. This study was performed to examine the effect of kidney dysfunction on the afore-mentioned markers and determine appropriate cutoffs for systolic heart failure (SHF).
Methods
In this cross sectional study adults with estimated glomerular filtration rate (eGFR) <60 ml/min for ≥3 months were identified in consulting clinics from June 2009 to March 2010. SHF was defined as documented by a cardiologist with ejection fraction of < 40% and assessed by New York Heart Association classification (NYHA). Plasma was assayed for creatinine (Cr), BNP and NT-proBNP.
Results
A total of 190 subjects were enrolled in the study, 95 with and 95 without SHF. The mean age of patients was 58 (±15) years, 67.4% being males. Mean BNP levels showed a 2.5 fold and 1.5 fold increase from chronic kidney disease (CKD) stage 3 to stage 5 in patients with and without SHF respectively. NT-proBNP levels in non-heart failure group were 3 fold higher in CKD stage 5 compared to stage 3. Mean NT-proBNP levels were 4 fold higher in CKD stage 5 compared to stage 3 in patients with SHF. Optimal BNP and NT-proBNP cutoffs of SHF diagnosis for the entire CKD group were 300 pg/ml and 4502 pg/ml respectively.
Conclusion
BNP and NT-proBNP were elevated in kidney dysfunction even in the absence of SHF; however the magnitude of increase in NT-proBNP was greater than that of BNP. BNP and NT-proBNP can be useful in diagnosing SHF, nonetheless, by using higher cutoffs stratified according to kidney dysfunction. NT-proBNP appears to predict heart failure better than BNP.
摘要
背景
受損腎功能對B型利尿肽(BNP)和N末端前BNP(NT-proBNP)的影響尚不清楚。本研究旨在檢查腎功能不全對上述標誌物的影響,並確定收縮性心力衰竭(SHF)的適當截止值。
方法
在此橫斷面研究中,從2009年6月至2010年3月,於諮詢診所中確定了估計腎小球過濾率(eGFR)<60 ml/min持續≥3個月的成人。SHF由心臟病專家根據射血分數<40%並通過紐約心臟協會分類(NYHA)評估來確定。血漿樣本用於測定肌酐(Cr)、BNP和NT-proBNP。
結果
共有190名受試者參與研究,其中95人患有SHF,95人沒有SHF。患者平均年齡為58(±15)歲,男性占67.4%。與無SHF患者相比,患有SHF的患者從慢性腎病(CKD)3期到5期BNP水平顯示出2.5倍和1.5倍的增加。在非心力衰竭組中,CKD 5期與3期相比,NT-proBNP水平增加了3倍。在患有SHF的患者中,CKD 5期與3期相比,NT-proBNP平均水平增加了4倍。對於整個CKD組SHF診斷的最佳BNP和NT-proBNP截止值分別為300 pg/ml和4502 pg/ml。
結論
即使在沒有SHF的情況下,腎功能不全也會使BNP和NT-proBNP升高;然而,NT-proBNP的增加幅度大於BNP。BNP和NT-proBNP可以用於診斷SHF,儘管如此,需要根據腎功能障礙使用更高的截止值。NT-proBNP似乎比BNP更能預測心力衰竭。
背景
來自美國、澳洲和中國的文獻報告稱,慢性腎病(CKD)的盛行率範圍在11-13.1%之間【1-4】。巴基斯坦的社區基礎研究揭示,超過40歲的受試者中CKD的負擔很高,範圍在15到20%之間【5】。由於缺乏文件記錄和資金,巴基斯坦CKD的確切盛行率仍然未知,但考慮到這一地區糖尿病和高血壓的流行,預計該率會很高【6-8】。隨著腎小球過濾率(GFR)的下降,心力衰竭的盛行率增加,達到終末期腎病的患者中有多達35%已經有心力衰竭的臨床證據【9】。為了預防心力衰竭的發生,需要一個可靠的標誌物來觀察此類患者的心臟負荷。B型利尿肽(BNP)和N-末端前體B型利尿肽(NT-proBNP)是已建立的心力衰竭標誌物,但CKD的同時存在以顯著方式改變了它們的解釋【10-13】。
BNP和NT-proBNP主要來自左心室肌細胞。心室擴張被認為是釋放proBNP1-108的主要刺激。這種前體激素被釋放到血液中,並被蛋白酶裂解成生物活性的BNP1-32和非活性的NT-proBNP1-76。proBNP在血液中的裂解過程最有可能是由pro-protein convertases corin和furin進行【14, 15】。proBNP的處理確實很複雜,在心力衰竭中特別是釋放了大量未處理的proBNP。一些近期研究已經顯示,血液中完整BNP的量很少,BNP的主要流通形式是降解產物。這些降解產物和完整的proBNP在BNP檢測中被不同程度地檢測到【16】。BNP的合成和釋放在基因表達層面受到控制,主要由心室肥大、炎症或拉伸控制【17】。BNP的清除機制是通過內吞作用隨後的溶酶體降解,以及通過非特異性膜結合酶中性內肽酶的降解,但NT-proBNP主要通過腎臟清除【18-20】。兩者以1:1的比例釋放,但NT-proBNP的水平高於BNP,因為其半衰期為15-20分鐘,而NT-proBNP的半衰期被估計為更長(1-2小時)【21, 22】。
我們假設隨著腎功能的下降,NT-proBNP將比BNP受到更多的影響。在CKD中診斷心力衰竭的理想利尿肽仍然未定。本研究旨在評估受損腎功能對利尿肽(BNP或NT-proBNP)的影響,並確定預測收縮性心力衰竭(SHF)的最佳截止值。
方法
研究人群和程序
這是一項橫斷面研究,於2009年6月至2010年3月的10個月期間,在卡拉奇阿迦汗大學的化學病理學部門、病理學和微生物學系與腎病學和心臟病學單位合作進行。阿迦汗大學倫理審查委員會批准了研究中涉及的所有調查程序(參考編號:1054-Path-ERC-08)。通過非概率配額抽樣法從診所中招募連續的成年步行患者,這些患者有腎功能受損。在獲得知情同意後,填寫了包括患者人口統計學、臨床歷史、吸煙史、飲酒史和藥物史的表格。記錄患者的體重和身高,以確定體質指數(BMI)。
腎功能受損被認為是估計的腎小球過濾率(eGFR)≤60 ml/min。使用Cockcroft Gault公式根據研究對象的血漿肌酐(Cr)、年齡和體重來估算GFR【23】。根據CKD分期將對象分為第3期(eGFR 30–60 ml/分鐘)、第4期(eGFR 15–29 ml/分鐘)和第5期(eGFR <15 ml/分鐘)【24】。根據面談資料和體檢結果使用紐約心臟協會(NYHA)分類患者是否患有SHF,然後從過去的心臟超聲報告(射血分數<40%)或檔案中心臟科醫生記錄的SHF再次確認【25】。接受透析治療和體質指數>30 kg/m^2的肥胖患者未納入本研究。由於內源性和外源性激素均已顯示能在血液中誘導BNP/NT-proBNP水平升高,因此懷孕的女性、正在接受激素治療或服用避孕藥的女性也未納入本研究組【26, 27】。每位參與患者抽取6毫升血樣,放入含有乙二胺四乙酸(EDTA)的真空采血管中進行分析。通過離心樣本獲得血漿,用於分析BNP、NT-proBNP和肌酐。
生化測量
在獲得知情同意後收集血漿樣本,以3000g離心10分鐘,分裝,冷凍並保持在-80°C。所有樣本分批進行血漿BNP、NT-proBNP和Cr的測定。BNP水平通過在Axym分析儀(Abbott diagnostic)上進行的自動化電化學發光免疫分析(ECLIA)測量。NT-proBNP水平通過在Elecsys分析儀(Roche diagnostic)上進行的自動化ECLIA測量。血漿Cr水平通過在Synchron分析儀(Beckman Coulter)上使用速率-Jaffe反應(校準物可追溯至同位素稀釋質譜參考方法)測量。為確保質量,每批BNP、NT-proBNP和Cr分析時均進行正常和異常控制。
統計分析
數據分析使用SPSS版本19進行。通過Kolomogorov-Smirnove測試檢查正態性後,對BNP和NT-proBNP值進行對數轉換。計算連續變量的平均值和±標準差(SD)或中位數及第25至第95百分位數。二分變量以百分比表示。使用t檢驗、單因素方差分析(ANOVA)或卡方檢驗檢測組間差異,視情況而定。使用Bonferroni方法進行不同組別中對數BNP/NT-proBNP的事後比較。在單變量分析中使用p值<0.2的變量,然後使用ENTER方法進入多元回歸模型。結果報告為標準化ß系數。構建接收操作特徵(ROC)曲線並計算BNP和NT-proBNP檢測SHF的曲線下面積(AUC)。為了提高特異性而犧牲靈敏度,ROC曲線左上角的最上端不用於計算截止值。所有上述統計分析中,p值<0.05被視為顯著。
結果
研究人群
表1展示了參與本研究的一百九十名研究對象的特徵、醫療歷史和生化結果。所有研究對象的射血分數(EF)均可獲得。研究人群的平均年齡為58±15歲,大多數為男性(67.4%)。有和沒有SHF的腎功能受損對象的腎功能受損持續時間中位數分別為18個月(四分位範圍=3 – 160個月)和24個月(四分位範圍=6 – 190個月)(p值>0.05)。在有和沒有SHF的男性和女性之間,平均log BNP/NT-proBNP之間的差異統計上不顯著(p值>0.05)。
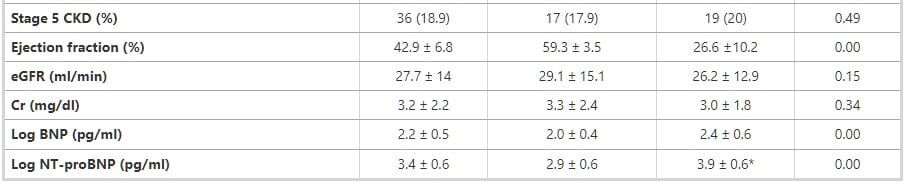
表1 基於心臟功能將腎功能受損患者分為兩組的臨床特徵和生化數據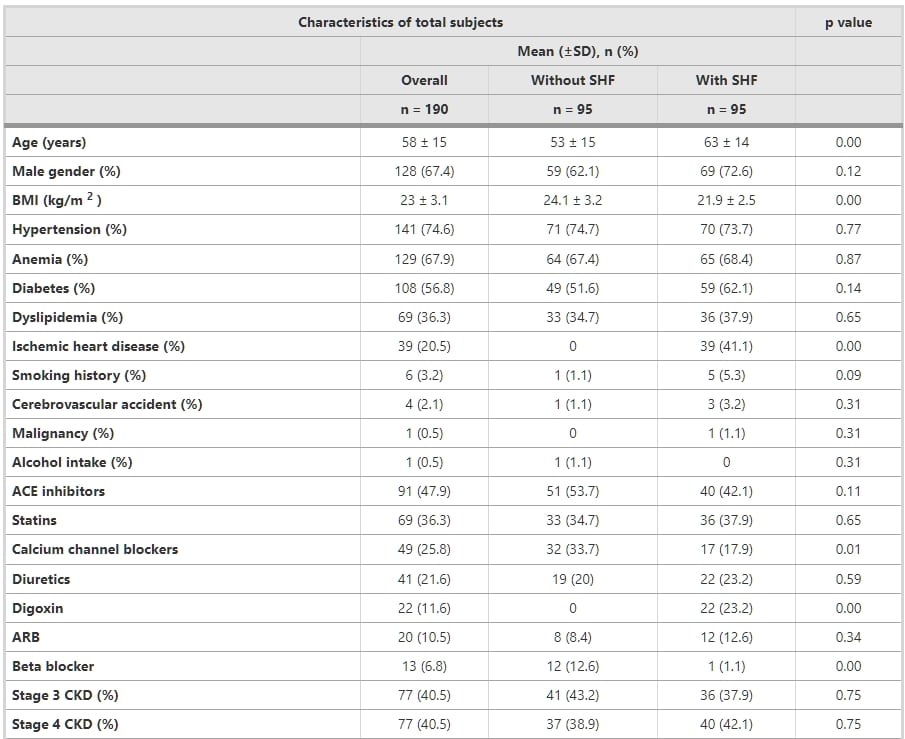
多變量預測因素對利尿肽的影響
在單變量分析中,將log BNP/log NT-proBNP作為依賴變量,使用以下預測變量:年齡、性別、BMI、eGFR、射血分數、糖尿病、高血壓、缺血性心臟病、腦血管事故、血脂異常、貧血、吸煙史、鈣通道阻斷劑、β-受體阻斷劑、他汀類藥物、地高辛、血管緊張素轉換酶抑製劑、血管緊張素受體阻斷劑、利尿劑和腎病持續時間。表2顯示了基於全部受試者數量的BNP和NT-proBNP的最終多變量回歸模型。log NT-proBNP的顯著預測因素被發現為年齡、BMI、SHF、NYHA階段和eGFR。隨著估算的eGFR下降,NT-proBNP濃度逐漸增加。log BNP和log NT-proBNP與EF(分別為-0.3和-0.6)呈現負相關。BNP和NT-proBNP與NYHA功能分類顯著相關。
表1 基於心臟功能將腎功能受損患者分為兩組的臨床特徵和生化數據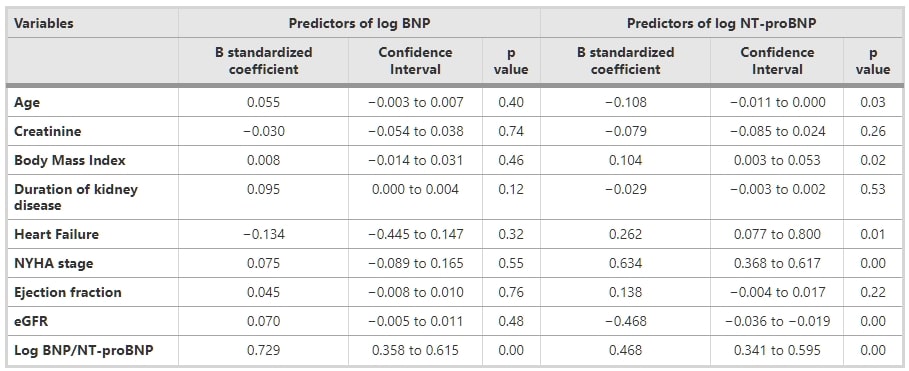
根據紐約心臟協會分類(NYHA)的利尿肽比較
根據NYHA分類,35.8%屬於NHYA 1級,19.5%屬於NYHA 2級,30%屬於NYHA 3級,14.7%屬於NYHA 4級。這四個級別的中位數BNP分別為80.8(42.6-163.2)、200(118.7-331)、478(144.1 – 742.7)、和409.4(285.8-720.3)pg/ml。針對多重比較進行了事後檢驗,使用Bonferroni alpha(0.05),揭示了NYHA I級、II級和III級之間的log BNP存在顯著差異,而NYHA III級與IV級之間的差異不顯著。NYHA級別中的中位數log NT-proBNP分別為535.1(191.9- 876.)、4192(1505.8-7105)、13831(4640.5-31230.5)和22520(9693.2-35000)pg/ml。ANOVA結果顯示,所有四個NYHA分類級別中的log NT-proBNP水平之間存在顯著的平均差異(p值<0.05)。隨著NYHA級別的提高,注意到eGFR逐漸下降(r = - 0.2,p值<0.05)。
腎功能障礙與利尿肽
隨著eGFR的下降,兩種利尿肽均顯示出上升趨勢,如圖1所示。CKD 3、4和5的中位數BNP值分別為106.3(43.1 – 281.6)、266.6(108.9 – 589.3)和328.9(142.1 – 650.6)pg/ml。CKD 3、4和5的中位數NT-proBNP值分別為799(227 – 5230)、5004(905.5 – 14776.5),和11215.5(3532.5 – 35000)pg/ml。
圖1 對數轉換後的血漿B型利尿肽(BNP)和氨基末端B型利尿肽(NT-proBNP)與估算腎小球過濾率(eGFR)關係的散點圖。繪製了最佳線性擬合線。隨著腎功能的惡化,血漿BNP和NT-proBNP水平逐步升高,隨著收縮性心力衰竭(SHF)的加重,這些水平顯著提高(圖2A和B)。在CKD第5期伴隨NYHA第3類的患者中,觀察到最高的BNP水平,而在CKD第5期伴隨NYHA第3類的患者中,觀察到最高的NT-proBNP濃度。
圖2 慢性腎病和紐約心臟協會分類對利尿肽影響。A. 根據CKD階段和NYHA分類的Log BNP。B. 根據CKD階段和NYHA分類的Log NT-proBNP。通過對總體患者群體中的log BNP和log NT-proBNP進行頭對頭比較,揭示了兩種肽之間的持續關係。對數轉換後的BNP水平與對數轉換後的NT-proBNP水平相關(r = 0.43,p值 <0.05)。在僅有腎功能障礙而無SHF的患者中,BNP與NT-proBNP的關聯性更高(r = 0.7,p值 <0.05),相較於同時患有腎功能障礙和SHF的患者(r = 0.55,p值 <0.05)。在伴有CKD 5階段的SHF組中,兩種肽之間顯示出的相關性不顯著。
BNP和NT-proBNP的濃度不可互換。在無SHF的患者中,從CKD第3階段到第5階段,平均BNP水平顯示出1.5倍的增加。在SHF患者中,隨著CKD階段從第3階段進展到第5階段,BNP水平觀察到2.5倍的增加。在非心力衰竭組中,平均NT-proBNP水平顯著上升,在CKD第5階段與第3階段相比,水平高出三倍。同樣,在SHF患者中,CKD第5階段與第3階段相比,平均NT-proBNP水平高出四倍。
接收者操作特徵曲線(ROC)分析和推薦截斷值
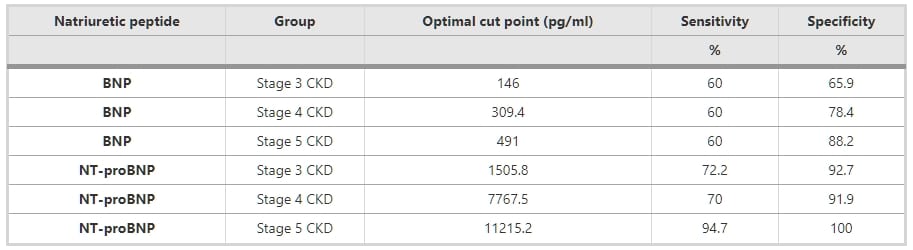
如圖3所示,BNP和NT-proBNP的檢測在腎功能受損患者中保持敏感和特異,由AUC指示。ROC分析顯示,BNP和NT-proBNP的AUC分別為0.7(95% CI 0.63 – 0.78,p值 <0.05)和0.86(95% CI 0.81 – 0.91,p值 <0.05)(圖4)。圖4A、B和C顯示了根據CKD分期的BNP和NT-proBNP的ROC分析。表3和4顯示了用於診斷整個研究組SHF的BNP和NT-proBNP的最佳截斷值,以及根據CKD分期的截斷值。
圖3 整個研究組心力衰竭的BNP和NT-proBNP的ROC曲線。BNP和NT-proBNP的曲線下面積分別為0.70和0.86。 圖4 根據慢性腎病(CKD)分期的BNP和NT-proBNP的接收操作特性(ROC)曲線。 (A) 對於CKD第3階段,BNP和NT-proBNP的曲線下面積(AUC)分別為0.66和0.88。 (B) 對於CKD第4階段,BNP和NT-proBNP的曲線下面積(AUC)分別為0.74和0.85。 (C) 對於CKD第5階段,BNP和NT-proBNP的曲線下面積(AUC)分別為0.77和1.00。 表3 用於評估所有CKD患者收縮性心力衰竭的潛在BNP和NT-proBNP截斷值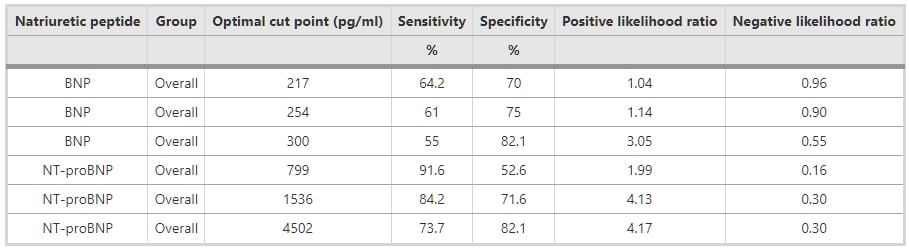
討論
多項試驗報告指出,腎功能受損會增加這些利尿肽的水平,但對於不同患者群體,最佳截斷值並不明確。這是來自這一地區的首項研究,增加了這些心臟標記在特定腎臟人群中的臨床應用價值。研究人群代表了具有已知腎功能障礙的典型門診患者,這是一個高度相關的人群群體,用於探索BNP和NT-proBNP作為心力衰竭標記的實用性。當前研究解決了BNP和NT-proBNP作為腎病患者心力衰竭標記的實用性。這項研究的結果與先前的研究一致,揭示了腎功能與BNP(r = -0.3)和NT-proBNP(r = -0.5)之間存在反向關係。BNP和NT-proBNP之間的頭對頭比較顯示,在SHF組中,NT-proBNP遠高於BNP,且兩者值不可互換。使用ROC分析,NT-proBNP的AUC優於整個研究人群中的BNP,以及CKD分期的子組。
在本研究群體中,相較於血漿BNP水平,血漿NT-proBNP水平受到下降的eGFR的影響更大,加上在診斷SHF中血漿NT-proBNP的最佳截斷值顯著受到腎功能障礙嚴重程度的影響。對於在腎功能受損患者中診斷SHF的BNP和NT-proBNP水平的截斷值存在很大爭議。一般來說,根據製造商的產品說明書,BNP和NT-proBNP值100 pg/ml和125 pg/ml被認為是異常的,並提示心力衰竭。這些標記的優點是它們能夠排除急性心力衰竭的診斷。一般來說,在BNP值<100 pg/ml時,心力衰竭不太可能,而在BNP值>500 pg/ml時,心力衰竭非常可能,同樣,在NT-proBNP值<300 pg/ml時,心力衰竭不太可能,而在NT-proBNP值>450 pg/ml時,心力衰竭非常可能。McCullough等人先前從“呼吸不正常多國研究”中報告了一項分析,其中發現BNP水平與有無心力衰竭的患者的腎功能相關。McCullough等人報告,在eGFR <60 ml/min/1.73 m2的患者中,將BNP的診斷值約為200 pg/ml是適當的。Jae Wong Yang等人指出,使用BNP截斷值858.5 pg/ml可以診斷腎功能障礙患者的心力衰竭,敏感度為77%,特異度為72%。Anwaruddin等人(PRIDE研究)注意到,在eGFR<60 ml/min的患者中,使用NT-proBNP截斷值1200 pg/ml可以診斷心力衰竭,敏感度為89%,特異度為72%。報告稱,在GFR>60 ml/min的患者中,NT-proBNP的AUC為0.95用於檢測心力衰竭,然而,在GFR<60 ml/min的患者中,NT-proBNP檢測仍然敏感且特異,AUC為0.88。在我們的研究人群中,檢測心力衰竭的AUC對於NT-proBNP傾向於大於BNP。
腎功能障礙是一個使BNP和NT-proBNP的解釋複雜化的變量。正如先前報告的那樣,這項研究的發現建議,在腎功能受損患者中診斷SHF需要更高的BNP和NT-proBNP截斷點。我们建议在eGFR <60 ml/min的患者中診斷SHF時,BNP和NT-proBNP的截斷水平分別為300 pg/ml和4502 pg/ml。Luchner等人在腎功能障礙的心肌梗死後患者中展示了更低的截斷點;BNP為125 pg/ml,NT-proBNP為350 pg/ml。他們使用的NT-proBNP檢測與當前研究中使用的相同(Roche diagnostics),但腎功能障礙組的平均eGFR為71±12 ml/min,主要包括輕度腎功能障礙患者。
我們的結果顯示,NT-proBNP比BNP更依賴於腎功能,但使用更高的NT-proBNP截斷值比BNP具有更好的診斷準確性。鑑於CKD患者中左心室肥大和左心室收縮功能障礙的高發生率,在這一人群中排除心力衰竭變得重要。在目前的研究中,一半的患者伴有腎功能障礙和SHF,這對於利尿肽檢測的使用具有重要意義。在腎功能受損患者中,血漿BNP和NT-proBNP水平與NYHA症狀嚴重程度相關。在大量研究中一致發現,心力衰竭患者的BNP和NT-proBNP水平升高,並且發現這些值與NYHA功能等級評估的疾病嚴重程度相關。在最近報告的一項大型CKD隊列研究中,發現NT-proBNP水平與左心室肥大和功能障礙之間存在強烈的關聯。在同一研究中,NT-proBNP提高了臨床模型預測CKD患者收縮功能障礙的能力。
我們研究中的明顯有症狀患者(n = 28),被分類為NYHA四級,具有非常高的BNP和NT-proBNP水平(中位數分別為409.4和22520 pg/ml)。BNP的生物活性包括利尿、鈉尿和抑制腎素-血管緊張素系統、內皮素分泌和全身及腎交感活動。矛盾的是,在充血性心力衰竭中,常規檢測測得的高BNP水平與這種激素的無效果相關。心臟的“內分泌悖論”現象以心力衰竭患者血液中極高的利尿肽水平為特徵,顯示出液體滯留和血管收縮的跡象。一些最近的發現表明,商業上可用的免疫分析方法傾向於逐漸高估心力衰竭患者中利尿肽的真實生物活性。
研究人群已經患有腎功能障礙;因此,疾病持續時間可能是當前研究的一個混淆因素。理想情況下應排除可能提高BNP和NT-proBNP水平的隱性心肌缺血。在亞洲人群中使用Cockcroft Gault公式估算GFR是有爭議的,但在我們的設置中觀察到Cockcroft Gault和肌酐清除率之間有良好的一致性。患有CKD的患者既患有收縮性也患有舒張性心力衰竭,但在當前研究中沒有考慮保持收縮功能正常的心力衰竭患者。研究的另一個限制是數據子類別中的小樣本大小,需要進一步的研究來可靠地推導截斷值。不同BNP和MT-proBNP檢測的分析性能存在差異,因此對於所有BNP/NT-proBNP免疫分析建議相同的截斷值或決策值可能不正確。
結論
血漿BNP和NT-proBNP的生產廠商提供的產品說明書中只使用了一個在正常人群中使用的單一截斷值,並未提及在腎功能受損患者中使用它們的限制。事實是,許多心力衰竭患者也有腎功能不全。因此,當前研究在使臨床醫生意識到如何在伴隨腎病時解釋結果方面非常重要,也對試劑盒生產商來說,應將其包含在他們的產品標籤中。這兩種利尿肽檢測可以用於腎功能受損的患者,但需要根據腎功能障礙使用更高的截斷值。NT-proBNP似乎比BNP更能預測SHF。腎功能障礙使得這些利尿肽的解釋變得複雜。為了提高護理質量和隨後的預後,血漿BNP和尤其是NT-proBNP的值應與腎功能障礙的嚴重程度相關聯來解釋。
參考文獻
-
Coresh J, Astor BC, Greene T, Eknoyan G, Levey AS: Prevalence of chronic kidney disease and decreased kidney function in the adult US population: third national health and nutrition examination survey. Am J Kidney Dis. 2003, 41 (1): 1-12.
-
Chadban SJ, Briganti EM, Kerr PG, Dunstan DW, Welborn TA, Zimmet PZ, Atkins RC: Prevalence of kidney damage in Australian adults: The AusDiab kidney study. J Am Soc Nephrol. 2003, 14: S131-S138. 10.1097/01.ASN.0000070152.11927.4A.
-
Zuo L, Ma YC, Zhou YH, Wang M, Xu GB, Wang HY: Application of GFR-estimating equations in Chinese patients with chronic kidney disease. Am J Kidney Dis. 2005, 45 (3): 463-472. 10.1053/j.ajkd.2004.11.012.
-
Coresh J, Selvin E, Stevens LA, Manzi J, Kusek JW, Eggers P, Van Lente F, Levey AS: Prevalence of chronic kidney disease in the United States. JAMA. 2007, 298: 2038-2047. 10.1001/jama.298.17.2038.
-
Jafar TH, Schmid CH, Levey AS: Serum creatinine as marker of kidney function in South Asians: a study of reduced GFR in adults in Pakistan. J Am Soc Nephrol. 2005, 16 (5): 1413-1419. 10.1681/ASN.2004121100.
-
King H, Aubert RE, Herman WH: Global burden of diabetes, 1995–2025: prevalence, numerical estimates, and projections. Diabetes Care. 1998, 21 (9): 1414-1431. 10.2337/diacare.21.9.1414.
-
Singh RB, Suh IL, Singh VP, Chaithiraphan S, Laothavorn P, Sy RG, Babilonia NA, Rahman AR, Sheikh S, Tomlinson B, Sarraf-Zadigan N: Hypertension and stroke in Asia: prevalence, control and strategies in developing countries for prevention. J Hum Hypertens. 2000, 14: 749-763. 10.1038/sj.jhh.1001057.
-
Hameed K, Kadir M, Gibson T, Sultana S, Fatima Z, Syed A: The frequency of known diabetes, hypertension and ischaemic heart disease in affluent and poor urban populations of Karachi, Pakistan. Diabet Med. 1995, 12 (6): 500-503. 10.1111/j.1464-5491.1995.tb00531.x.
-
Curtis BM, Parfrey PS: Congestive heart failure in chronic kidney disease: disease-specific mechanisms of systolic and diastolic heart failure and management. Cardiol Clin. 2005, 23 (3): 275-284. 10.1016/j.ccl.2005.04.002.
-
Wright SP, Doughty RN, Pearl A, Gamble GD, Whalley GA, Walsh HJ, Gordon G, Bagg W, Oxenham H, Yandle T, Richards M, Sharpe N: Plasma amino-terminal pro-brain natriuretic peptide and accuracy of heart-failure diagnosis in primary care: a randomized, controlled trial. J Am Coll Cardiol. 2003, 42: 1793-1800. 10.1016/j.jacc.2003.05.011.
-
Shapiro BP, Chen HH, Burnett JC, Redfield MM: Use of plasma brain natriuretic peptide concentration to aid in the diagnosis of heart failure. Mayo Clin Proc. 2003, 78 (4): 481-486. 10.4065/78.4.481.
-
McCullough PA, Duc P, Omland T, McCord J, Nowak RM, Hollander JE, Herrmann HC, Steg PG, Westheim A, Knudsen CW, Storrow AB, Abraham WT, Lamba S, Wu AHB, Perez A, Clopton P, Krishnaswamy P, Kazanegra R, Maisel AS: B-type natriuretic peptide and renal function in the diagnosis of heart failure: an analysis from the Breathing Not Properly Multinational Study. Am J Kidney Dis. 2003, 41 (3): 571-579. 10.1053/ajkd.2003.50118.
-
Dhar S, Pressman GS, Subramanian S, Kaul S, Gollamudi S, Bloom EJ, Figueredo VM: Natriuretic peptides and heart failure in the patient with chronic kidney disease: a review of current evidence. Postgrad Med J. 2009, 85: 299-302. 10.1136/pgmj.2008.073734.
-
Clerico A, Giannoni A, Vittorini S, Passino C: Thirty years of the heart as an endocrine organ: physiological role and clinical utility of cardiac natriuretic hormones. Am J Physiol Heart Circ Physiol. 301 (1): H12-H20.
-
Daniels LB, Maisel AS: Natriuretic peptides. J Am Coll Cardiol. 2007, 50 (25): 2357-2368. 10.1016/j.jacc.2007.09.021.
-
Tonne JM, Campbell JM, Cataliotti A, Ohmine S, Thatava T, Sakuma T, Macheret F, Huntley BK, Burnett JC, Ikeda Y: Secretion of glycosylated pro-B-type natriuretic peptide from normal cardiomyocytes. Clin Chem. 57: 864-873.
-
Hama N, Itoh H, Shirakami G, Nakagawa O, Suga S, Ogawa Y, Masuda I, Nakanishi K, Yoshimasa T, Hashimoto Y: Rapid ventricular induction of brain natriuretic peptide gene expression in experimental acute myocardial infarction. Circulation. 1995, 92: 1558-1564. 10.1161/01.CIR.92.6.1558.
-
Soleilhac JM, Lucas E, Beaumont A, Turcaud S, Michel JB, Ficheux D, Fournie-Zaluski MC, Roques BP: A 94-kDa protein, identified as neutral endopeptidase-24.11, can inactivate atrial natriuretic peptide in the vascular endothelium. Mol Pharmacol. 1992, 41: 609-614.
-
Vanderheyden M, Bartunek J, Goethals M: Brain and other natriuretic peptides: molecular aspects. Eur J Heart Fail. 2004, 6 (3): 261-268. 10.1016/j.ejheart.2004.01.004.
-
Chen HH, Burnett JC: The natriuretic peptides in heart failure: diagnostic and therapeutic potentials. Proc Assoc Am Physicians. 1999, 111 (5): 406-416.
-
McCullough PA, Omland T, Maisel AS: B-type natriuretic peptides: a diagnostic breakthrough for clinicians. Rev Cardiovasc Med. 2003, 4 (2): 72-80.
-
Levin ER, Gardner DG, Samson WK: Natriuretic peptides. N Engl J Med. 1998, 339 (5): 321-328. 10.1056/NEJM199807303390507.
-
Cockcroft DW, Gault MH: Prediction of creatinine clearance from serum creatinine. Nephron. 1976, 16 (1): 31-41. 10.1159/000180580.
-
: K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis. 2002, 39 (2 Suppl 1): S1-S266.
-
Dickstein K, Cohen-Solal A, Filippatos G, McMurray JJ, Ponikowski P, Poole-Wilson PA, Stromberg A, van Veldhuisen DJ, Atar D, Hoes AW, Keren A, Mebazaa A, Nieminen M, Priori SG, Swedberg K: ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur Heart J. 2008, 29 (19): 2388-2442.
-
Maffei S, Del Ry S, Prontera C, Clerico A: Increase in circulating levels of cardiac natriuretic peptides after hormone replacement therapy in postmenopausal women. Clin Sci (Lond). 2001, 101 (5): 447-453. 10.1042/CS20010039.
-
Karjalainen AH, Ruskoaho H, Vuolteenaho O, Heikkinen JE, Backstrom AC, Savolainen MJ, Kesaniemi YA: Effects of estrogen replacement therapy on natriuretic peptides and blood pressure. Maturitas. 2004, 47: 201-208. 10.1016/S0378-5122(03)00279-2.
-
Luchner A, Hengstenberg C, Lowel H, Buchner S, Schunkert H, Riegger GA, Holmer S: NT-ProBNP in outpatients after myocardial infarction: interaction between symptoms and left ventricular function and optimized cut-points. J Card Fail. 2005, 11: S21-27. 10.1016/j.cardfail.2005.04.018.
-
deFilippi CR, Seliger SL, Maynard S, Christenson RH: Impact of renal disease on natriuretic peptide testing for diagnosing decompensated heart failure and predicting mortality. Clin Chem. 2007, 53 (8): 1511-1519. 10.1373/clinchem.2006.084533.
-
Anwaruddin S, Lloyd-Jones DM, Baggish A, Chen A, Krauser D, Tung R, Chae C, Januzzi JL: Renal function, congestive heart failure, and amino-terminal pro-brain natriuretic peptide measurement: results from the ProBNP Investigation of Dyspnea in the Emergency Department (PRIDE) Study. J Am Coll Cardiol. 2006, 47: 91-97. 10.1016/j.jacc.2005.08.051.
-
Luchner A, Hengstenberg C, Lowel H, Riegger GA, Schunkert H, Holmer S: Effect of compensated renal dysfunction on approved heart failure markers: direct comparison of brain natriuretic peptide (BNP) and N-terminal pro-BNP. Hypertension. 2005, 46 (1): 118-123. 10.1161/01.HYP.0000170140.36633.8f.
-
Felker GM, Petersen JW, Mark DB: Natriuretic peptides in the diagnosis and management of heart failure. CMAJ. 2006, 175 (6): 611-617.
-
National Clinical Guideline Centre (UK): Chronic Heart Failure: National Clinical Guideline for Diagnosis and Management in Primary and Secondary Care: Partial Update [Internet]. 2010, London: Royal College of Physicians (UK), (NICE Clinical Guidelines, No. 108.) Available from: http://www.ncbi.nlm.nih.gov/books/NBK65340/
-
Jessup M, Abraham WT, Casey DE, Feldman AM, Francis GS, Ganiats TG, Konstam MA, Mancini DM, Rahko PS, Silver MA, Stevenson LW, Yancy CW: 2009 focused update: ACCF/AHA Guidelines for the Diagnosis and Management of Heart Failure in Adults: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines: developed in collaboration with the International Society for Heart and Lung Transplantation. Circulation. 2009, 119: 1977-2016.
-
McCullough PA, Kuncheria J, Mathur VS: Diagnostic and therapeutic utility of B-type natriuretic peptide in patients with renal insufficiency and decompensated heart failure. Rev Cardiovasc Med. 2003, 4 (Suppl 7): S3-S12.
-
Yang JW, Kim MS, Kim JS, Yoo JM, Han ST, Kim BR, Kim YD, Choi SO, Han BG: Relationship between serum brain natriuretic peptide and heart function in patients with chronic kidney disease. Korean J Intern Med. 2008, 23: 191-200. 10.3904/kjim.2008.23.4.191.
-
McCullough PA, Nowak RM, McCord J, Hollander JE, Herrmann HC, Steg PG, Duc P, Westheim A, Omland T, Knudsen CW: B-type natriuretic peptide and clinical judgment in emergency diagnosis of heart failure: analysis from Breathing Not Properly (BNP) Multinational Study. Circulation. 2002, 106: 416-422. 10.1161/01.CIR.0000025242.79963.4C.
-
Ouanes I, Jalloul F, Ayed S, Dachraoui F, Ouanes-Besbes L, Fekih Hassen M, Elatrous S, Abroug F: N-terminal proB-type natriuretic peptide levels aid the diagnosis of left ventricular dysfunction in patients with severe acute exacerbations of chronic obstructive pulmonary disease and renal dysfunction. Respirology. 17: 660-666.
-
Zhao XY, Yang YJ, Zhang J, Kang LM, Wei BQ, Gao XJ, Lu R, Zhang CL: Association of plasma amino-terminal pro-A-, B- and C-type natriuretic peptide levels with NYHA grade and echocardiographic derived parameters of cardiac function in heart failure patients. Zhonghua Xin Xue Guan Bing Za Zhi. 2009, 37: 486-490.
-
Nagaya N, Nishikimi T, Okano Y, Uematsu M, Satoh T, Kyotani S, Kuribayashi S, Hamada S, Kakishita M, Nakanishi N, Takamiya M, Kunieda T, Matsuo H, Kangawa K: Plasma brain natriuretic peptide levels increase in proportion to the extent of right ventricular dysfunction in pulmonary hypertension. J Am Coll Cardiol. 1998, 31: 202-208.
-
Mishra RK, Li Y, Ricardo AC, Yang W, Keane M, Cuevas M, Christenson R, deFilippi C, Chen J, He J, Kallem RR, Raj DS, Schelling JR, Wright J, Go AS, Shlipak MG: Association of N-terminal pro-B-type natriuretic peptide with left ventricular structure and function in chronic kidney disease (from the Chronic Renal Insufficiency Cohort [CRIC]). Am J Cardiol. 111: 432-438.
-
Tsutamoto T, Wada A, Maeda K, Hisanaga T, Maeda Y, Fukai D, Ohnishi M, Sugimoto Y, Kinoshita M: Attenuation of compensation of endogenous cardiac natriuretic peptide system in chronic heart failure: prognostic role of plasma brain natriuretic peptide concentration in patients with chronic symptomatic left ventricular dysfunction. Circulation. 1997, 96: 509-516. 10.1161/01.CIR.96.2.509.
-
Goetze JP, Kastrup J, Rehfeld JF: The paradox of increased natriuretic hormones in congestive heart failure patients: does the endocrine heart also fail in heart failure?. Eur Heart J. 2003, 24 (16): 1471-1472. 10.1016/S0195-668X(03)00283-5.
-
Goetze JP: Biochemistry of pro-B-type natriuretic peptide-derived peptides: the endocrine heart revisited. Clin Chem. 2004, 50 (9): 1503-1510. 10.1373/clinchem.2004.034272.
-
Chen HH: Heart failure: a state of brain natriuretic peptide deficiency or resistance or both!. J Am Coll Cardiol. 2007, 49 (10): 1089-1091. 10.1016/j.jacc.2006.12.013.
-
Clerico A, Zaninotto M, Prontera C, Giovannini S, Ndreu R, Franzini M, Zucchelli GC, Plebani M: State of the art of BNP and NT-proBNP immunoassays: the CardioOrmoCheck study. Clin Chim Acta. 414: 112-119.



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย