本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
2019年ESC/EAS關於血脂異常管理的指南強調了降低心血管風險的重要性。該指南涵蓋了膽固醇、高密度和低密度脂蛋白、甘油三酯及家族性高膽固醇血症等多個領域。它不僅討論了藥物治療的最新進展,還強調了生活方式改變在治療中的重要性,並提供了總體心血管風險評估和治療遵從性的指導。
2019年歐洲心臟病學會/歐洲動脈粥樣硬化學會關於管理血脂異常的指南:為減少心血管風險進行脂質調節
2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk
François Mach, Colin Baigent, Alberico L Catapano, Konstantinos C Koskinas, Manuela Casula, Lina Badimon, M John Chapman, Guy G De Backer, Victoria Delgado, Brian A Ference, Ian M Graham, Alison Halliday, Ulf Landmesser, Borislava Mihaylova, Terje R Pedersen, Gabriele Riccardi, Dimitrios J Richter, Marc S Sabatine, Marja-Riitta Taskinen, Lale Tokgozoglu, Olov Wiklund, ESC Scientific Document Group
Collaborators expand
PMID: 31504418 DOI: 10.1093/eurheartj/ehz455
https://pubmed.ncbi.nlm.nih.gov/31504418/
https://academic.oup.com/eurheartj/article/41/1/111/5556353?login=false#
Preamble
Guidelines summarize and evaluate available evidence with the aim of assisting health professionals in proposing the best management strategies for an individual patient with a given condition. Guidelines and their recommendations should facilitate decision making of health professionals in their daily practice. However, the final decisions concerning an individual patient must be made by the responsible health professional(s) in consultation with the patient and caregiver as appropriate.
A great number of guidelines have been issued in recent years by the European Society of Cardiology (ESC) and its partners such as European Atherosclerosis Society (EAS), as well as by other societies and organisations. Because of their impact on clinical practice, quality criteria for the development of guidelines have been established in order to make all decisions transparent to the user. The recommendations for formulating and issuing ESC Guidelines can be found on the ESC website (http://www.escardio.org/Guidelines-&-Education/Clinical-Practice-Guidelines/Guidelines-development/Writing-ESC-Guidelines). The ESC Guidelines represent the official position of the ESC on a given topic and are regularly updated.
The ESC carries out a number of registries which are essential to assess diagnostic/therapeutic processes, use of resources and adherence to Guidelines. These registries aim at providing a better understanding of medical practice in Europe and around the world, based on data collected during routine clinical practice.
The guidelines are developed together with derivative educational material addressing the cultural and professional needs for cardiologists and allied professionals. Collecting high-quality observational data, at appropriate time interval following the release of ESC Guidelines, will help evaluate the level of implementation of the Guidelines, checking in priority the key end points defined with the ESC Guidelines and Education Committees and Task Force members in charge.
The Members of this Task Force were selected by the ESC and EAS, including representation from relevant ESC sub-specialty groups, in order to represent professionals involved with the medical care of patients with this pathology. Selected experts in the field from both societies undertook a comprehensive review of the published evidence for management of a given condition according to ESC Committee for Practice Guidelines (CPG) policy. A critical evaluation of diagnostic and therapeutic procedures was performed, including assessment of the risk–benefit ratio. The level of evidence and the strength of the recommendation of particular management options were weighed and graded according to predefined ESC scales, as outlined in the tables below.
The experts of the writing and reviewing panels provided declaration of interest forms for all relationships that might be perceived as real or potential sources of conflicts of interest. These forms were compiled into one file and can be found on the ESC website (http://www.escardio.org/guidelines). Any changes in declarations of interest that arise during the writing period were notified to the ESC and EAS Chairpersons and updated. The Task Force received its entire financial support from the ESC and EAS without any involvement from the healthcare industry.
The ESC CPG supervises and coordinates the preparation of new Guidelines. The Committee is also responsible for the endorsement process of these Guidelines. The ESC Guidelines undergo extensive review by the CPG and external experts. After appropriate revisions the Guidelines are approved by all the experts involved in the Task Force. The finalized document is approved by the CPG and EAS for publication in the European Heart Journal and Atherosclerosis Journal. The Guidelines were developed after careful consideration of the scientific and medical knowledge and the evidence available at the time of their dating.
The task of developing ESC/EAS Guidelines also includes the creation of educational tools and implementation programmes for the recommendations including condensed pocket guideline versions, summary slides, booklets with essential messages, summary cards for non-specialists and an electronic version for digital applications (smartphones, etc.). These versions are abridged and thus, for more detailed information, the user should always access the full text version of the Guidelines, which is freely available via the ESC and EAS websites and hosted on their journals’ websites (EHJ and Atherosclerosis Journal). The National Cardiac Societies of the ESC are encouraged to endorse, translate and implement all ESC Guidelines. Implementation programmes are needed because it has been shown that the outcome of disease may be favourably influenced by the thorough application of clinical recommendations.
Health professionals are encouraged to take the ESC/EAS Guidelines fully into account when exercising their clinical judgment, as well as in the determination and the implementation of preventive, diagnostic or therapeutic medical strategies. However, the ESC/EAS Guidelines do not override in any way whatsoever the individual responsibility of health professionals to make appropriate and accurate decisions in consideration of each patient’s health condition and in consultation with that patient or the patient’s caregiver where appropriate and/or necessary. It is also the health professional’s responsibility to verify the rules and regulations applicable in each country to drugs and devices at the time of prescription.
表1 建議等級分類

前言
指南總結並評估了可用證據,目的是為了幫助醫療專業人員為患有特定病情的個別病人提出最佳管理策略。指南及其建議應促進醫療專業人員在日常實踐中的決策。然而,關於個別病人的最終決定必須由負責的醫療專業人員在適當時與病人和護理人員協商後作出。
近年來,歐洲心臟病學會(ESC)及其合作夥伴,如歐洲動脈粥樣硬化學會(EAS),以及其他社團和組織已發布了大量指南。由於這些指南對臨床實踐的影響,已建立了發展指南的質量標準,以使所有決策對使用者透明。有關制定和發布ESC指南的建議可以在ESC網站上找到(http://www.escardio.org/Guidelines-&-Education/Clinical-Practice-Guidelines/Guidelines-development/Writing-ESC-Guidelines)。ESC指南代表ESC對給定主題的官方立場,並定期更新。
ESC進行了一些註冊,這些註冊對於評估診斷/治療過程、資源使用和遵循指南至關重要。這些註冊的目標是在基於日常臨床實踐期間收集的數據基礎上,為歐洲和世界各地的醫療實踐提供更好的理解。
這些指南與衍生的教育材料一起開發,以滿足心臟病學家和相關專業人員的文化和專業需求。在ESC指南發布後的
適當時間間隔內收集高質量的觀察數據,將有助於評估指南實施的水平,首要檢查與ESC指南和教育委員會以及負責任務小組成員共同確定的關鍵終點。
此任務小組的成員由ESC和EAS選定,包括來自ESC相關子專業小組的代表,以代表參與該病理病人醫療護理的專業人員。來自兩個學會的領域專家根據ESC實踐指南委員會(CPG)政策,對特定病情的管理進行了全面的證據評估。進行了對診斷和治療程序的嚴格評估,包括風險-利益比的評估。特定管理選項的證據水平和建議強度按照預定的ESC等級進行了權衡和分級,如下表所示。
撰寫和審查小組的專家為所有可能被認為是實際或潛在利益衝突的關係提供了利益申報表格。這些表格被彙編成一個檔案,可在ESC網站上找到(http://www.escardio.org/guidelines)。在撰寫期間出現的任何利益申報的變化都會通知給ESC和EAS主席並進行更新。任務小組從ESC和EAS獲得了全部的財政支持,而沒有醫療行業的任何參與。
ESC CPG監督並協調新指南的準備工作。該委員會還負責這些指南的認可過程。ESC指南經過CPG和外部專家的廣泛審查。經過適當的修訂後,指南由參與任務小組的所有專家批准。最終文件由CPG和EAS批准,在《歐洲心臟雜誌》和《動脈粥樣硬化雜誌》上發表。在撰寫指南時,經過仔細考慮了當時可用的科學和醫學知識及證據。
開發ESC/EAS指南的任務還包括為建議創建教育工具和實施計劃,包括簡化的口袋指南版本、摘要幻燈片、帶有重要信息的小冊子、非專業人士的摘要卡片和數字應用(智能手機等)的電子版本。這些版本是簡略版,因此,為了獲得更詳細的信息,用戶應始終訪問指南的完整文本版本,該版本可通過ESC和EAS網站免費獲得,並托管在其期刊網站(EHJ和《動脈粥樣硬化雜誌》)上。ESC的國家心臟學會被鼓勵認可、翻譯和實施所有ESC指南。實施計劃是必需的,因為已經表明,通過徹底應用臨床建議可以有利地影響疾病的結果。
鼓勵衛生專業人員在行使其臨床判斷時充分考慮ESC/EAS指南,以及在確定和實施預防、診斷或治療醫學策略時。然而,ESC/EAS指南絕不以任何方式取代衛生專業人員在考慮每位患者的健康狀況並在適當和/或必要時與患者或患者的護理人員協商時,作出適當和準確決策的個人責任。衛生專業人員還負有在開處方時核實每個國家對藥物和設備的規則和法規的責任。
2.1 2019年指南的新內容是什麼?
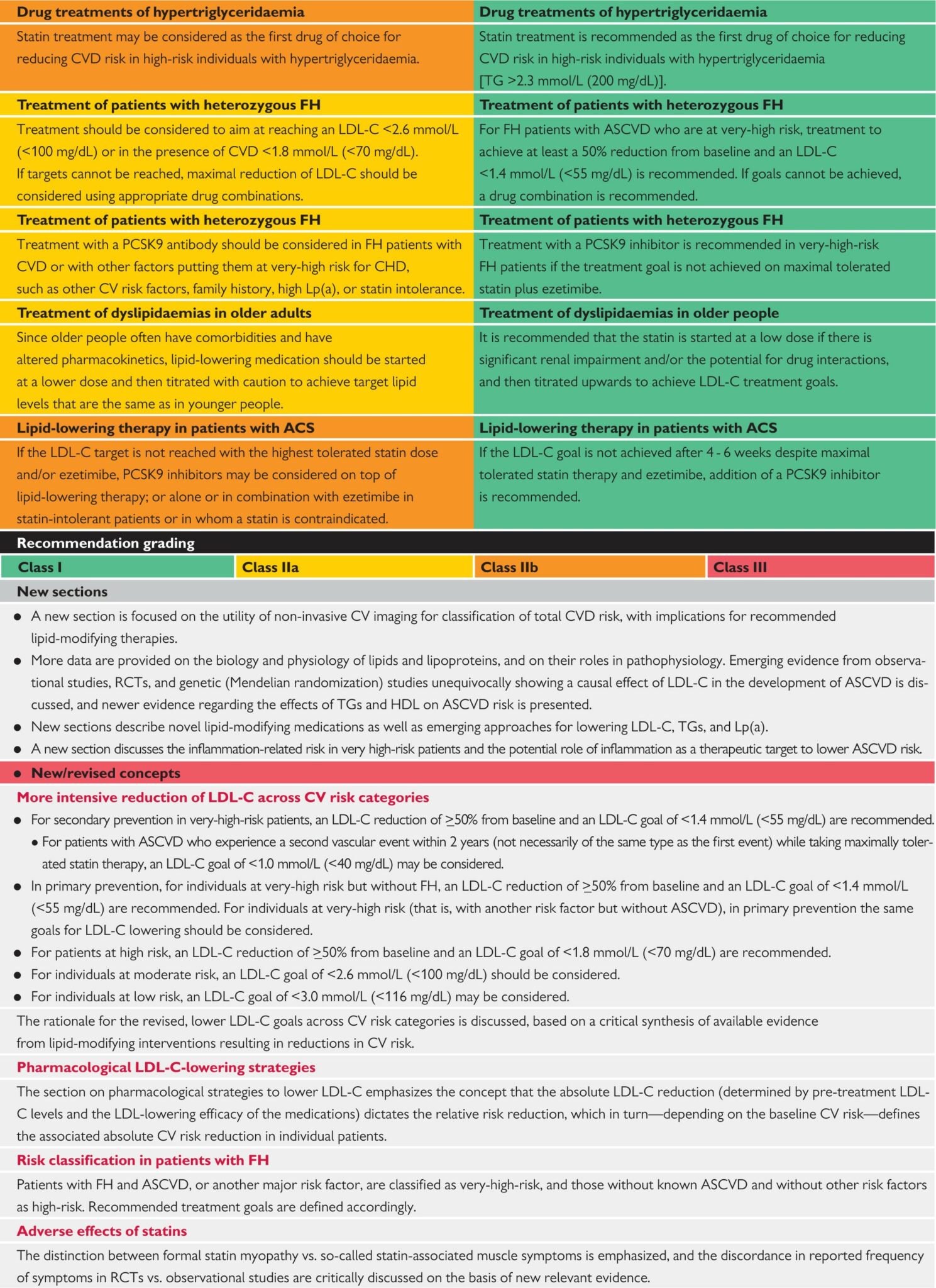
ACS = 急性冠狀動脈綜合徵;ApoB = 脂蛋白B;ASCVD = 動脈粥樣硬化心血管疾病;CAC = 冠狀動脈鈣化;CHD = 冠狀心臟病;CT = 電腦斷層掃描;CV = 心血管;CVD = 心血管疾病;DM = 糖尿病;FH = 家族性高膽固醇血症;HDL = 高密度脂蛋白;LDL-C = 低密度脂蛋白膽固醇;Lp(a) = 脂蛋白(a);PCSK9 = 前蛋白轉化酶/酶抑製劑/凱克斯酶9型;PUFAs = 多不飽和脂肪酸;RCTs = 隨機對照試驗;T1DM = 1型糖尿病;T2DM = 2型糖尿病;TGs = 甘油三酯。
3 心血管疾病預防是什麼?
3.1 定義和理由
心血管疾病(CVD),其中動脈粥樣硬化心血管疾病(ASCVD)是主要組成部分,每年在歐洲造成超過400萬人死亡。它導致的女性死亡(220萬)多於男性(180萬),儘管在65歲以下的心血管死亡在男性中更常見(49萬 vs. 19.3萬)。3 預防被定義為一系列協調的行動,無論是在人群還是個體層面,旨在消除或最小化心血管疾病及其相關殘疾的影響。越來越多的患者在經歷了第一次CVD事件後生存下來,並且面臨復發的高風險。此外,某些風險因素,特別是糖尿病(DM)和肥胖的流行率正在上升。ASCVD預防的重要性無可爭議,應通過促進健康的生活方式行為4在一般人群中進行,並通過解決不健康的生活方式,在個體層面減少LDL膽固醇或血壓(BP)等致病心血管風險因素的水平。
3.2 發展聯合任務小組對血脂異常管理的指南
目前的指南代表了歐洲任務小組的基於證據的共識,包括ESC和EAS。通過評估當前證據並識別血脂異常管理中仍然存在的知識差距,任務小組制定了建議,以指導臨床實踐中通過修改血漿脂質水平來預防ASCVD的行動。
本文件旨在幫助醫療專業人員與個體進行有關其心血管風險及採取和持續健康生活方式的益處,以及早期修改其與脂質相關的心血管風險的知情溝通。此外,這些指南為醫療專業人員提供了工具,以促進最新的干預策略,將這些策略整合到國家或地區的預防框架中,並將其轉化為本地提供的醫療服務,符合世界衛生組織(WHO)2014年非傳染性疾病全球狀況報告的建議。5
應該考慮對心血管風險的終身方法。1 這意味著——除了在已確診ASCVD的患者和那些有增加ASCVD風險的患者中改善生活方式習慣和降低風險因素水平外——鼓勵所有年齡的人採取或維持健康的生活方式。
4 總心血管風險
4.1 總心血管風險評估
在這些指南的背景下,心血管(CV)風險意味著一個人在定義的時間內發展成動脈粥樣硬化CV事件的可能性。總心血管疾病(CVD)風險表示多個風險因素對這一風險估計的綜合影響。在這些指南中,我們著重於與脂質相關的總心血管風險貢獻以及如何在臨床層面管理它。
4.1.1 評估總心血管疾病風險的理由
當前關於臨床實踐中預防ASCVD的所有指南都推薦評估總CVD風險。對特定個體進行ASCVD的預防應與其總CV風險相關:風險越高,應採取的行動就越密集。
目前有許多風險評估系統可用,並已進行了全面評估(補充資料中的補充表1)。大多數指南使用這些風險評估系統之一。6-8 理想情況下,風險圖應基於國家特定的群體數據。大多數國家沒有這些數據。SCORE(系統性冠狀動脈風險估計)系統可以通過調整CVD死亡率和風險因素流行率的時間變化來重新校準以適用於不同的人群。校準的國家特定版本可用於許多歐洲國家,可在http://www.heartscore.org找到。這些現在正在更新,以為所有歐洲國家提供重新校準的當代國家特定圖表。其他風險估計系統——使用致命和非致命事件——也可以重新校準,但對於死亡率而非總事件來說,這個過程更容易且科學上更可靠。歐洲臨床實踐中CVD預防指南(20129和201610版本)推薦使用SCORE系統,因為它基於大型、代表性的歐洲群體數據集,並且相對容易為個別國家重新校準。
有記錄的ASCVD、1型或2型糖尿病(T1DM和T2DM)、非常高的個別風險因素水平或慢性腎病(CKD)的人通常處於非常高或高的總
CV風險。這些人不需要風險估計模型;他們都需要積極管理所有風險因素。對於其他看似健康的人來說,推薦使用像SCORE這樣的風險估計系統,該系統估計10年累積首次致命動脈粥樣硬化事件的風險,因為許多人有幾個風險因素,這些因素結合起來可能導致高水平的總CV風險。
風險估計已作為歐洲高風險和低風險地區的圖表產生(圖1和圖2)。11 所有與動脈粥樣硬化引起的血管源性死亡相關的國際疾病分類代碼都被包括在內。保留估計致命而非總致命+非致命事件的系統的原因是,非致命事件取決於定義、診斷測試的發展和確定方法,所有這些都可能變化,導致將致命事件轉換為總事件的乘數變化很大。此外,與基於死亡率的圖表相比,總事件圖表更難以重新校準以適應不同人群。儘管如此,正在進行工作以產生區域性總事件圖表。
圖1系統性冠狀動脈風險估計圖,用於心血管疾病高風險的歐洲人群。基於以下風險因素:年齡、性別、吸煙、收縮壓和總膽固醇,該人群10年內心血管疾病致命風險的估計。要將心血管疾病的致命風險轉換為總(致命+非致命)心血管疾病風險,在男性中乘以3,在女性中乘以4,在老年人中稍微減少。注意:系統性冠狀動脈風險估計圖用於沒有明顯心血管疾病、糖尿病(1型和2型)、慢性腎病、家族性高膽固醇血症或個別風險因素非常高的人,因為這些人已處於高風險並需要密集的風險因素管理。膽固醇:1毫摩/升 = 38.67毫克/分升。上述SCORE風險圖表與2016年歐洲心臟病學會/歐洲動脈粥樣硬化學會血脂異常管理指南和2016年歐洲臨床實踐中心血管疾病預防指南略有不同,原因在於:(i) 年齡已從65歲延伸到70歲;(ii) 將年齡與其他每個風險因素之間的交互作用納入,從而減少了原始系統性冠狀動脈風險估計圖表中對老年人風險的高估;(iii) 移除了8毫摩/升的膽固
醇帶,因為這些人在任何情況下都將符合進一步評估的資格。SCORE = 系統性冠狀動脈風險估計。
圖2系統性冠狀動脈風險估計圖,用於心血管疾病低風險的歐洲人群。基於以下風險因素:年齡、性別、吸煙、收縮壓和總膽固醇,該人群10年內心血管疾病致命風險的估計。要將心血管疾病的致命風險轉換為總(致命+非致命)心血管疾病風險,在男性中乘以3,在女性中乘以4,在老年人中稍微減少。注意:系統性冠狀動脈風險估計圖用於沒有明顯心血管疾病、糖尿病(1型和2型)、慢性腎病、家族性高膽固醇血症或個別風險因素非常高的人,因為這些人已處於高風險並需要密集的風險因素管理。膽固醇:1毫摩/升=38.67毫克/分升。上述SCORE風險圖表與2016年歐洲心臟病學會/歐洲動脈粥樣硬化學會血脂異常管理指南和2016年歐洲臨床實踐中心血管疾病預防指南略有不同,原因在於:(i) 年齡已從65歲延伸到70歲;(ii) 將年齡與其他每個風險因素之間的交互作用納入,從而減少了原始系統性冠狀動脈風險估計圖表中對老年人風險的高估;(iii) 移除了8毫摩/升的膽固醇帶,因為這些人在任何情況下都將符合進一步評估的資格。SCORE = 系統性冠狀動脈風險估計。
SCORE數據顯示,對於男性而言,總CVD事件風險約為致命CVD風險的三倍,因此5%的SCORE風險相當於總(致命+非致命)CVD終點約15%的風險;這個乘數在女性中更高,在老年人中較低。
臨床醫師經常詢問觸發特定干預的閾值。這是有問題的,因為風險是一個連續體,並不存在一個特定的閾值,例如自動表明需要用藥。對於所有連續性風險因素,如血漿膽固醇或收縮壓(SBP),都是如此。因此,本文件提出的目標反映了這一概念。
特別的問題與擁有高風險因素水平的年輕人有關;低的絕對風險可能隱藏了非常高的相對風險,需要至少進行積極的生活方式建議。為了激勵年輕人(即年齡<40歲)不要延遲改變他們的不健康生活方式,估計他們的相對風險——說明生活方式的改變可以顯著降低相對風險——可能是有幫助的(補充圖1)。
解決這個問題的另一種方法是使用CV風險年齡。具有多個CV風險因素的人的風險年齡是具有相同風險水平但風險因素理想的人的年齡。因此,一個高風險的40歲人士將會有一個≥65歲的風險年齡。可以通過查看SCORE圖表(如補充圖2所示)來直觀估計風險年齡。在這個圖表中,具有風險因素的人的風險年齡被定義為具有理想風險因素水平的人達到相同風險水平的年齡。理想風險因素是不吸煙,總膽固醇(TC)≤4 mmol/L(≤155 mg/dL),收縮壓≤120 mmHg。風險年齡也是HeartScore的最新修訂版本的自動計算部分(http://
www.HeartScore.org)。
風險年齡已被證明與使用的CV終點無關,6,8 可用於任何人群,無論基線風險或死亡率的時間變化如何,因此避免了重新校準的需要。
終身風險是另一種方法,用於說明風險因素的影響,對年輕人可能有用。12 風險因素的負擔越大,終身風險越高。這種方法因他們更長的暴露時間而為年輕人產生更高的風險數字。因此,它更適用於說明風險,而不是作為治療的指導,因為治療試驗基於固定的隨訪期而非終身風險。
老年人也存在問題。在某些年齡類別中,尤其是男性,大多數人的估計10年累積CV死亡風險將超過5-10%的水平,僅基於年齡,即使其他CV風險因素水平相對較低。因此,在老年人開始治療之前,臨床醫師應該仔細評估患者。風險因素的相對強度隨年齡變化,SCORE在老年人(即年齡>65歲)中高估風險。11 這些指南包括老年人的示例圖表(見圖1和圖2)。雖然老年人從戒煙和控制高血壓和高脂血症中受益(見第9.3節),但需要臨床判斷以避免過度用藥的副作用。
HDL-C對風險估計的額外影響在補充圖3和4中有所說明;HDL-C可
用於提高風險評估的準確性。在這些圖表中,HDL-C被分類使用。SCORE的電子版本,HeartScore(http://www.heartscore.org/en_GB/),已被修改以將HDL-C作為連續變量考慮在內。臨床醫生應該知道,在極高值[HDL-C超過約2.3 mmol/L(90 mg/dL)]時,ASCVD的風險似乎會增加,所以在這些水平上,HDL-C不能用作風險預測器。
4.1.2 如何使用風險估計圖表
使用低風險或高風險SCORE圖表將取決於每個國家的心血管疾病死亡經驗。雖然任何切點都是隨意的且有爭議的,但在這些指南中,將一個國家定義為“低心血管疾病風險”的切點是基於世界衛生組織從全球疾病負擔研究中獲得的數據。
如果國家的2016年年齡調整後的心血管疾病死亡率低於150/100,000(男女合計)(http://www.who.int/healthinfo/global_burden_disease/estimates/en/),則被歸類為低風險國家。心血管疾病死亡率在150/100,000或更高的國家被認為是高風險的。
4.2 風險等級
總CV風險估計是一個連續體的一部分。用於定義高風險的切點,在某種程度上既是隨意的,也是基於臨床試驗中明顯受益的風險水平。在臨床實踐中,應考慮與當地醫療系統相關的實際問題。不僅應識別和管理高風險者,還應向中度風險者提供有關生活方式改變的專業建議;在某些情況下,需要藥物治療來降低動脈粥樣硬化風險。
低風險人群應得到幫助他們維持這一狀態的建議。因此,預防行動的強度應根據患者的總CV風險量身定制。總CV風險的最強驅動因素是年齡,可以被視為對風險因素的“暴露時間”。
基於這些原因,任務小組建議以下風險類別和LDL-C目標,基於最佳可用證據,在資源不受限制的理想環境中。這些類別代表了完美的建議,但這些理想僅供指導,實際決策必須基於適合當地情況的內容。
考慮到這些因素,我們提出了表4中呈現的總CV風險等級。
表4 心血管風險類別
ASCVD = 動脈粥樣硬化心血管疾病;ACS = 急性冠狀動脈綜合徵;BP = 血壓;CABG = 冠狀動脈搭橋手術;CKD = 慢性腎病;CT = 電腦斷層掃描;CVD = 心血管疾病;DM = 糖尿病;eGFR = 估算腎小球過濾率;FH = 家族性高膽固醇血症;LDL-C = 低密度脂蛋白膽固醇;MI = 心肌梗死;PCI = 經皮冠狀動脈介入治療;SCORE = 系統性冠狀動脈風險估計;T1DM = 1型糖尿病;T2DM = 2型糖尿病;TC = 總膽固醇;TIA = 短暫性腦缺血發作。
4.2.1 非侵入性心血管成像技術在評估總心血管疾病風險中的作用
非侵入性成像技術可以檢測動脈粥樣硬化血管損傷的存在、估計其範圍並評估其臨床後果。使用非對比劑電腦斷層掃描(CT)檢測冠狀動脈鈣化可以很好地估計動脈粥樣硬化負擔,並與心血管事件密切相關。18一項來自美國預防服務工作小組的最新Meta分析總結了關於非傳統風險因素在風險預測中價值的可用證據,發現雖然沒有隨機試驗表明使用冠狀動脈鈣化(CAC)可以減少健康結果,但它確實提高了區分和重新分類。19通過超聲波評估頸動脈或股動脈斑塊負擔也已被證明能預測心血管事件,與CAC相當,20-23而頸動脈內膜-中膜厚度的測量則不如CAC評分和頸動脈斑塊檢測。16,24,25
在低風險或中度風險的無症狀患者中,這些患者可能會接受他汀類藥物治療(見表5),使用成像方法評估ASCVD可能會對醫療治療產生影響,無論是從醫生還是患者的角度來看。多種族動脈粥樣硬化研究(MESA)的數據顯示,41-57%有資格接受他汀類治療的個體有零的CAC評分,而在10年的隨訪期間動脈粥樣硬化CVD事件的發生率很低(1.5-4.9%)。26相比之下,CAC評分>100 Agatston的個體中ASCVD和冠狀心臟病(CHD)事件的發生率分別為每1000人年18.9和12.7。18與治療所有患者的策略相比,使用CAC評分來指導長期他汀類治療已被證明是經濟有效的。27需要注意的是,年齡小於45
歲的嚴重家族性高膽固醇血症(FH)患者,包括同型合子FH(HoFH),CAC評分通常非常低,在這一人群中具有低特異性。
使用冠狀動脈CT血管造影評估冠狀腔內狹窄>50%和斑塊組成也提供了傳統風險分層模型之上的增量預後價值。28因此,在無症狀的中度風險個體中,存在CAC評分>100 Agatston以及超聲波檢測到的頸動脈或股動脈斑塊負擔可能將其重新分類為更高風險類別。因此,在這一組人群中使用方法來檢測這些標誌應該是值得關注的(見下方對於動脈粥樣硬化心血管疾病風險評估的心血管成像建議)。14-16總的來說,僅通過生活方式干預無法達到相應LDL-C目標的低風險或中度風險個體可能會考慮使用CT來進行CAC評分評估,並且藥物治療是一種選擇(見表5)。在不考慮接受他汀類治療的低風險個體中使用成像技術來確定動脈粥樣硬化血管損傷的存在和程度是不合理的,由於預後收益低,以及測量CAC評分時伴隨的成本和輻射危險,特別是在低風險女性中。值得注意的是,服用他汀類治療後CAC評分會增加;因此,應謹慎解釋服用他汀類治療患者的CAC評分。
4.2.2 基於風險的干預策略
表5提出了作為總CV風險和LDL-C水平功能的建議干預策略。這種分級方法基於來自多個meta分析和個別隨機對照試驗(RCT)的證據,這些證據顯示對TC和LDL-C水平的降低在應對ASCVD風險方面有一致且分級的減少(見下方心血管疾病風險估計的建議)。31-41這些數據一致表明,由於相對風險降低與LDL-C的絕對降低成比例,並且特定藥物方案導致的LDL-C絕對降低僅取決於基線LDL-C,在任何給定的基線風險水平下,初始LDL-C水平越高,風險的絕對降低越大。關於個別藥物治療的建議在第8節中給出。
表5 根據總心血管風險和未治療的低密度脂蛋白膽固醇水平的干預策略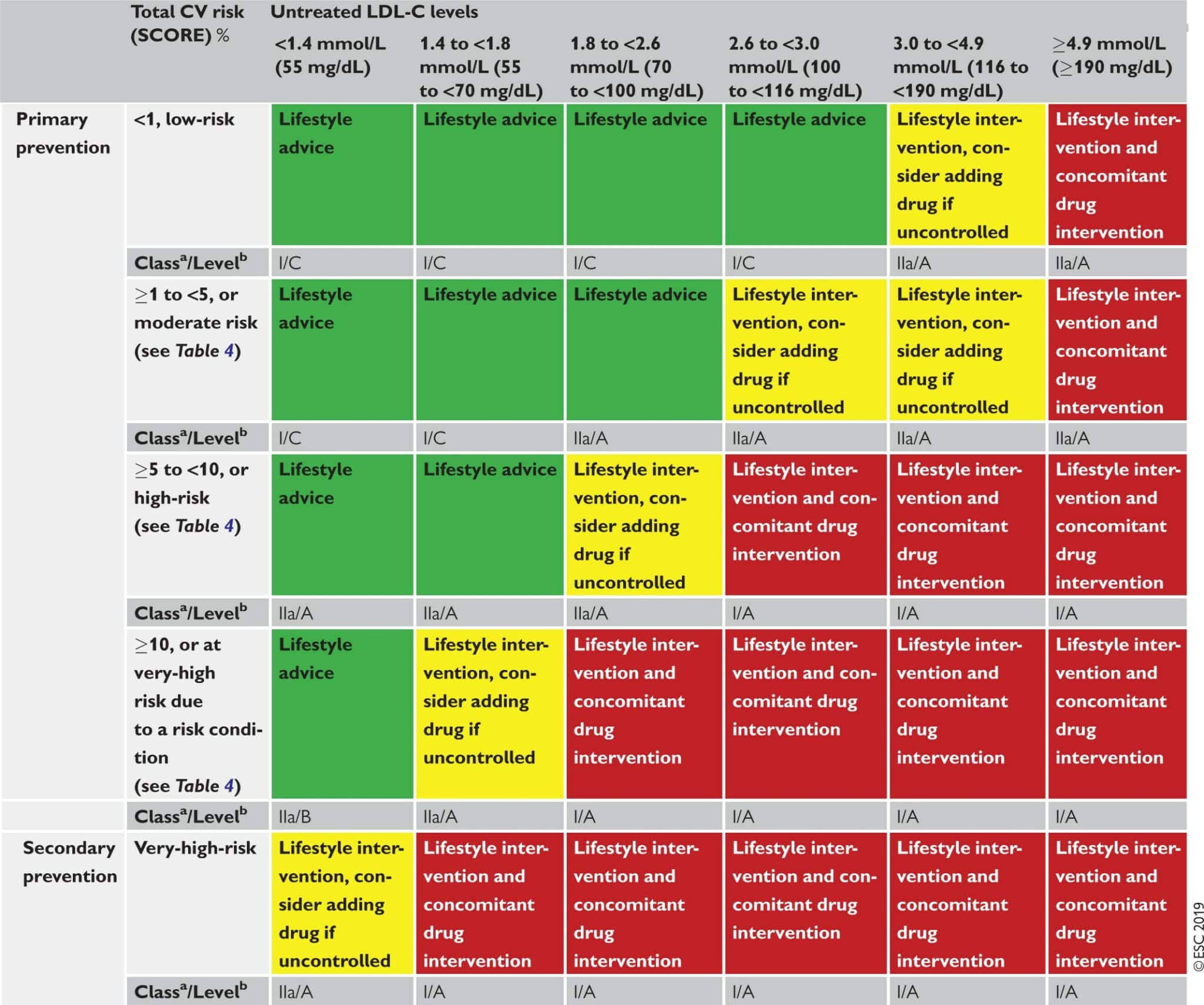
5 脂質和脂蛋白
5.1 脂質和脂蛋白的生物學作用
血漿中的脂蛋白將脂質運輸到組織中用於能量利用、脂質沉積、類固醇激素生產和膽酸形成。脂蛋白由酯化和非酯化膽固醇、甘油三酯(TGs)、磷脂和名為脂蛋白質的蛋白質組分組成,這些蛋白質作為結構組分、細胞受體結合配體以及酶活化劑或抑制劑。
血液中有六種主要脂蛋白:乳糜微粒、極低密度脂蛋白(VLDL)、中間密度脂蛋白(IDL)、低密度脂蛋白(LDL);Lp(a)和高密度脂蛋白(HDL)(表6和補充圖5)。
表6 人類血漿脂蛋白的物理和化學特性
5.2 脂質和脂蛋白在動脈粥樣硬化病理生理中的作用
所有含ApoB的脂蛋白,直徑<70納米,包括較小的甘油三酯富集脂蛋白及其殘留顆粒,都能穿過內皮屏障,特別是在內皮功能障礙的情況下,它們在與諸如蛋白多糖等細胞外結構的相互作用後可能被困在動脈壁內。42 被動脈壁保留的含ApoB脂蛋白會引發一個複雜的過程,導致脂質沉積和動脈粥樣斑塊的開始形成。43
持續接觸含ApoB的脂蛋白會導致隨時間在動脈壁中保留更多顆粒,以及動脈粥樣硬化斑塊的增長和進展。平均而言,血漿中含ApoB脂蛋白濃度較高的人將保留更多顆粒,脂質累積速度更快,導致動脈粥樣硬化斑塊的更快增長和進展。
由於動脈粥樣硬化斑塊隨著更多含ApoB脂蛋白顆粒的保留而隨時間增長,因此總動脈粥樣斑塊負擔的大小可能取決於循環LDL-C和其他含ApoB脂蛋白的濃度,以及這些脂蛋白總暴露時間。因此,一個人的總動脈粥樣斑塊負擔可能與這些脂蛋白的累積暴露成正比。44
最終,隨著動脈粥樣斑塊負擔的增加以及斑塊組成的變化達到臨界點,可能導致斑塊破裂,形成覆蓋性血栓,急性阻塞血流,導致不穩定型心絞痛、心肌梗死(MI)或死亡。因此,隨著更多含ApoB脂蛋白的保留和動脈粥樣斑塊負擔的增加,經歷急性ASCVD事件的風險迅速升高。這為鼓勵健康生活方式以維持低水平的含ApoB脂蛋白從而減緩動脈粥樣硬化進展提供了理由;它還解釋了推薦治療以降低LDL-C和其他含ApoB脂蛋白的動機,無論是用於ASCVD的一級預防還是用於心血管事件復發的二級預防。44
5.3 脂質和脂蛋白對動脈粥樣硬化心血管疾病風險的因果效應證據
5.3.1 低密度脂蛋白膽固醇和動脈粥樣硬化風險
血漿LDL-C是衡量LDL顆粒攜帶的膽固醇質量,是含ApoB脂蛋白中最多的,是血液循環中LDL濃度的估計。眾多流行病學研究、Mendelian隨機化研究和隨機對照試驗(RCT)一致證明了血漿LDL-C絕對變化與ASCVD風險之間的對數線性關係。34,45-50 這些研究之間的卓越一致性,加上生物學和實驗證據,提供了令人信服的證據,表明LDL-C與ASCVD風險有因果關聯,降低LDL-C可以根據實際達到的LDL-C減少程度,成比例地減少ASCVD風險。2,51
此外,Mendelian隨機化研究表明,長期暴露於較低LDL-C水平與心血管事件的風險大大降低相關,與短期暴露於較低LDL-C(例如,在隨機試驗中實現的)相比。48,52 這些數據強烈支持LDL顆粒對ASCVD風險具有因果和累積效應的概念。因此,LDL-C對ASCVD風險的影響似乎取決於LDL-C的絕對大小和總暴露時間。2
降低LDL-C的臨床益處由循環LDL顆粒的減少決定,如ApoB所估計的,通常反映為這些顆粒攜帶的膽固醇減少。2,53 因此,通過減少LDL顆粒質量降低LDL-C的治療的臨床益處將與LDL-C的絕對減少成比例,因為平均來說,LDL-C和LDL顆粒的減少將是一致的。34,50,54,55 相比之下,通過可能顯著改變其組成的機制降低LDL-C的治療
的臨床益處可能不成比例於觀察到的LDL-C的絕對減少,而應該與LDL顆粒濃度的絕對變化成比例,如ApoB減少所測量的。2,53
5.3.2 甘油三酯富含脂蛋白和動脈粥樣硬化風險
甘油三酯(TG)富含的超低密度脂蛋白(VLDL)顆粒及其殘基攜帶了大部分循環中的TG。因此,血漿TG濃度反映了循環中的ApoB富含的TG富含脂蛋白的濃度。
升高的血漿TG水平與ASCVD風險增加有關,但在校正非HDL-C後,這種關聯變得無效,非HDL-C是所有ApoB富含脂蛋白的總濃度的估計值。45 同樣,與LDL-C降低療法相比,使用纖維酸酯降低TG可以在每單位非HDL-C變化的情況下降低心血管事件的風險,50 這表明血漿TG對ASCVD的影響是通過非HDL-C估計的TG富含脂蛋白濃度的變化來介導的。
Mendelian隨機化研究還表明,血漿TG與冠心病風險之間的聯繫可能是因果關係;但是,必須謹慎解釋這一證據,因為幾乎所有與TG相關的變異體也與HDL-C、LDL-C或Lp(a)相關。56-59 最近的Mendelian隨機化研究表明,降低TG的脂蛋白脂肪酶(LPL)變異和降低LDL-C的LDL受體變異對每單位ApoB變化的ASCVD風險具有相同的效應,這表明所有ApoB富含的脂蛋白對冠心病風險具有相同的影響。53 綜上所述,這些研究強烈暗示,TG富含的脂蛋白及其殘基對ASCVD風險的因果效應是由循環中的ApoB富含粒子的濃度確定的,而不是由TG含量本身確定的。
5.3.3 高密度脂蛋白膽固醇與動脈粥樣硬化風險
血漿高密度脂蛋白膽固醇(HDL-C)與ASCVD風險之間的負相關在觀察性流行病學中是最一致和可重複的關聯之一。45,60 相比之下,Mendelian隨機化研究並未提供充分的證據,證明HDL-C與ASCVD風險存在因果關係。49,61,62 但是,必須謹慎解釋這一證據,因為大多數與HDL-C相關的基因變異體也與TG、LDL-C或兩者方向相反的變化相關,因此很難使用Mendelian隨機化研究設計來估計HDL-C對ASCVD風險的影響。此外,來自隨機試驗的證據顯示,治療性增加血漿HDL-C並不降低心血管事件的風險。63-67 在最近急性冠狀症患者中進行Dalcetrapib效果(dal-OUTCOMES)試驗中,使用膽固醇酯轉移蛋白(CETP)抑制劑dalcetrapib治療增加了HDL-C,但對LDL-C或ApoB沒有影響,但並未降低主要心血管事件的風險。65 同樣,在高風險患者中評估膽固醇酯轉移蛋白抑制劑的臨床效果(ACCELERATE)和通過脂質修改評估Anacetrapib效果的隨機評估(REVEAL)試驗中,CETP抑制劑治療導致HDL-C水平增加了一倍以上,但似乎未降低ASCVD事件的風險,超出了由ApoB水平的輕微降低所預期的範圍。2,63,64 此外,幾項隨機試驗表明,直接注入的HDL類似物增加了血漿HDL-C濃度,但未降低通過血管內超聲檢查測量的動脈粥樣硬化的進展。68,69
因此,目前還沒有隨機試驗或基因證據表明提高血漿HDL-C可能會降低ASCVD事件的風險。治療改變HDL顆粒功能是否會降低ASCVD風險目前尚不清楚。
5.3.4 脂蛋白(a)與動脈粥樣硬化風險
Lp(a)是一種具有Apo(a)部分共價結合到其ApoB組分的LDL顆粒。70 它的直徑小於70納米,可以自由通過內皮屏障,就像LDL一樣,在動脈壁內被滯留,因此可能增加ASCVD的風險。Lp(a)的促動脈粥樣硬化作用也被歸因於其促凝血作用,因為Lp(a)的結構類似於纖溶酶原,並且它對氧化磷脂所攜帶的負荷具有促發炎作用,最有可能與氧化磷脂有關。71
較高的血漿Lp(a)濃度與ASCVD風險增加相關,但對大多數人來說,Lp(a)似乎比LDL-C弱得多。72,73 相比之下,Mendelian隨機化研究一直一致顯示終身暴露於較高Lp(a)水平與ASCVD風險增加強烈且有因果關聯。74,75 雖然評估降低Lp(a) 20-30%的療法(包括維生素B3和CETP抑制劑)的隨機試驗並未提供證據表明降低Lp(a)能夠降低ASCVD風險,超出了從觀察到的ApoB-containing脂蛋白減少所預期的範圍,但最近的PCSK9抑制劑數據提出了Lp(a)降低可能在降低心血管風險方面具有潛在作用。76
這一矛盾的證據似乎已經在最近的Mendelian隨機化研究中得到了調和,該研究表明Lp(a)對ASCVD風險的因果效應與血漿Lp(a)水平的絕對變化成比例。重要的是,這項研究還建議,擁有極高Lp(a)水平>180 mg/dL(>430 nmol/L)的人可能具有類似於患有異質性FH(HeFH)的人壽命風險增加的風險。因為約90%的人的Lp(a)水平是遺傳的,所以極高的Lp(a)可能代表一種新的遺傳性脂質異常,與極高的終身ASCVD風險相關,並且比HeFH多出一倍。77 然而,這項研究77 和基於Heart Protection Study 2-治療高密度脂蛋白以減少血管事件發生率(HPS2-THRIVE)試驗的另一項研究78 顯示,可能需要大幅降低Lp(a)的絕對變化才能實現對ASCVD事件風險的臨床有意義的降低。
5.4 脂質和脂蛋白的實驗室測量
脂質和脂蛋白的測量用於估計ASCVD的風險並指導治療決策。可以對全血漿進行脂質的定量測量,並可以通過測量其蛋白質成分來實現脂蛋白的定量。在操作上,脂蛋白根據其水合密度進行分類(請參見表6)。
5.4.1 脂蛋白的測量
考慮到ApoB-containing脂蛋白在動脈粥樣硬化的啟動和進展中的中心因果作用,直接測量具有致動脈粥樣硬化作用的ApoB-containing脂蛋白的循環濃度以估算風險並指導治療決策將是理想的。因為所有包括VLDL、富含TG的殘餘顆粒和LDL在內的ApoB-containing脂蛋白都包含單個ApoB分子,所以ApoB的定量直接估算了血漿中具有致動脈粥樣硬化作用的顆粒的數量。
有標準化的、自動化的、準確的且價格低廉的測量ApoB的方法可用。無需禁食,因為即使在飯後狀態下,ApoB48-containing乳糜顆粒通常也僅代表循環ApoB-containing脂蛋白的總濃度的<1%。此外,ApoB測量方法的分析性能優於LDL-C和non-HDL-C的測量或計算。79
5.4.2 脂質測量
在臨床實踐中,通常不會直接測量血漿脂蛋白的濃度,而是通過測量其膽固醇含量來估算其濃度。人體中的TC主要分布在三個主要脂蛋白類別中:VLDL、LDL和HDL。還有少量膽固醇存在於兩個次要脂蛋白類別中:IDL和Lp(a)。標準的血清脂質配置文件測量TC和HDL-C的濃度,以及TG。使用這些數值,可以估算LDL-C的濃度。
血漿LDL-C可以通過直接使用酶法技術或制備性超速離心法來直接測量,但在臨床醫學中,通常使用Friedewald公式來計算:
LDL-C = TC − HDL-C − (TG/2.2)(以mmol/L表示)
或
LDL-C = TC − HDL-C − (TG/5)(以mg/dL表示)
儘管方便,但Friedewald計算的LDL-C具有幾個經過充分確立的限制:(i)由於該公式需要TC、TG和HDL-C的三個單獨分析,因此可能會積累方法學錯誤;(ii)假定VLDL中存在恒定的膽固醇/TG比。在高TG值(>4.5 mmol/L或>400 mg/dL)的情況下,無法使用該公式。這在非禁食樣本中尤其需要考慮。
為克服與計算的LDL-C相關的問題,已經開發了用於測量LDL-C的直接酶法。這些方法以自動分析為目的商業化提供。Friedewald方程和直接測量所定義的LDL-C相同:non-HDL-C – VLDL-C,代表生化定義的LDL、IDL和Lp(a)亞型所攜帶的膽固醇的總和。
對於一般人群,計算的LDL-C和直接的LDL-C之間存在非常強的相關性。然而,已發現在TG≥2 mmol/L(177 mg/dL)的濃度下,計算的LDL-C會低估LDL-C。同樣,在非常低的LDL-C水平下,計算的LDL-C可能具有誤導性,尤其在TG高的情況下。為了避免Friedewald公式的一些問題,已經提出了一些用於計算LDL-C的修改方法,但還需要證明這些修改是否優於Friedewald的公式來估計CV風險。值得注意的是,直接的LDL-C測量也存在局限性,包括在具有脂質代謝異常的患者中存在系統性偏差和不準確性,特別是對於高TG水平的患者。
作為替代的計算的LDL-C,可以計算non-HDL-C,即TC – HDL-C,它是由所有具有致動脈粥樣硬化作用的ApoB-containing脂蛋白攜帶的TC的測量,包括VLDL中的富含TG的顆粒及其殘餘物。100
有多種方法可以測定Lp(a)。Lp(a)的複雜分子結構和Apo(a)的大小變異對Lp(a)的分析方法的開發構成了挑戰。可用方法在不同程度上受到Apo(a)異構體的影響。此外,各種測試報告的Lp(a)濃度可以作為摩爾濃度(nmol/L)或質量(mg/dL)來表示,並且已發現在摩爾和質量濃度之間的轉換取決於大小和濃度。因此,需要在測試之間進行標準化,以建立可靠且重複的Lp(a)質量或粒子數量的定量方法。92
5.4.3 空腹或非空腹?
傳統上,建議對脂質分析進行血液採樣時應處於空腹狀態。最近的系統研究比較了空腹和非空腹樣本,結果顯示對於大多數脂質參數來說,差異很小。非空腹採樣已在大規模的以人口為基礎的研究中使用。在大多數研究中,非空腹樣本的平均TG水平高約0.3 mmol/L(27 mg/dL)。就平均而言,對大多數人來說,這種增加對臨床意義不大。事實上,一些指南建議使用非空腹樣本。
對於一般風險篩查,非空腹樣本似乎具有與空腹樣本至少相同的預測價值。非空腹樣本的實際優勢,包括更好的患者接受度,超過了一些患者可能存在的不精確性,盡管某些關鍵分析物(如空腹血糖)的測定可能會受到損害。此外,即使在大多數情況下可以使用非空腹樣本,但對於代謝綜合症(MetS)、糖尿病(DM)或高三酸甘油酯血症(HTG)的患者,應謹慎解釋計算的LDL-C。
5.5 用於估計動脈粥樣硬化心血管疾病風險的脂質和脂蛋白測量建議
需要測量血漿總膽固醇(TC)來使用SCORE計算風險,而包括血漿高密度脂蛋白膽固醇(HDL-C)水平可以通過在線SCORE計算器來改善風險估算。因此,應該測量TC和HDL-C來估算一個人使用SCORE或其他風險計算器(幾乎所有風險計算器也包括TC和HDL-C的測量)的ASCVD風險。
應該測量血漿低密度脂蛋白膽固醇(LDL-C)來估算可以通過LDL-C降低療法改變的ASCVD風險,並確定是否存在明顯升高的LDL-C水平,這可能表明由於終身累積高水平的致動脈粥樣硬化脂蛋白的暴露,如在FH中,可能存在終身高風險的ASCVD風險。血漿LDL-C可以計算或直接測量。
應該評估血漿三酸甘油脂(TG)以確定是否存在由於存在具有升高的致動脈粥樣硬化脂蛋白含有三酸甘油脂的粒子及其殘留物的濃度而反映的比LDL-C更高的可改變的ASCVD風險的人,並確定在計算和直接測量的LDL-C可能低估ASCVD風險的人,因為它們低估了循環LDL粒子的濃度或携带這些粒子的膽固醇含量,如LDL極低水平的那些人。這在DM或MetS患者中可能尤為重要。
一般來說,LDL-C、非HDL-C和ApoB的濃度高度相關。因此,在大多數情況下,它們提供關於ASCVD風險的非常相似的信息。然而,在某些情況下,包括TG水平升高、DM、肥胖或極低的已達到的LDL-C水平的人,計算或直接測量的LDL-C水平可能會低估LDL所攜帶的膽固醇總濃度以及更重要的是低估ApoB脂蛋白的總濃度,從而低估ASCVD風險。約有20%的患者可能存在測量的LDL-C和ApoB水平之間的不一致。
考慮到LDL-C在脂質異常、DM或高TG水平的患者中的潛在不準確性,建議在常規脂質分析中,對於血漿TG升高的患者,應該測量ApoB和非HDL-C。因為ApoB在所有情況下都提供了有關致動脈粥樣硬化粒子總濃度的準確估計,所以它是進一步精煉可通過降脂療法可修改的ASCVD風險估計的首選測量。
Lp(a)的結構類似於纖維蛋白溶解酶原並結合到纖維蛋白溶解酶原受體上,導致血栓形成增加(促血栓形成因子)。應該至少在每個人的一生中考慮測量Lp(a),以識別那些繼承了極高Lp(a)水平(≥180 mg/dL或≥430 nmol/L)並因此具有非常高的ASCVD終身風險的人,該風險大致相當於與HeFH相關的風險。此外,此策略還可以識別Lp(a)上升較小的人,他們可能具有比SCORE系統或其他脂質或脂蛋白測量所反映的更高的ASCVD風險,測量Lp(a)已被證明在某些情況下提供了具有臨床意義的風險重新分類,因此應該考慮在估算的ASCVD風險接近高風險和中風險之間的閾值的患者中進行測量。
6 治療目標與目標
在以前的EAS/ESC關於脂質異常管理的指南以及其他關於成年人降低動脈粥樣硬化心血管風險的血膽固醇治療的主要指南中,強調了降低LDL-C來預防ASCVD的重要性。歐洲工作組認為,將CV預防的當前知識局限於隨機對照試驗(RCTs)的結果會降低預防ASCVD的潛力的利用。許多不同方法(從基礎科學、臨床觀察、遺傳學、流行病學、隨機對照試驗等)的結論的一致性有助於理解ASCVD的原因和預防的潛力。工作組意識到某些證據來源的局限性,並接受RCTs並未系統地研究不同的LDL-C目標,但認為查看證據的整體性是合適的。特別考慮了來自元分析的結果,確認了與LDL-C降低劑量相關的ASCVD減少;絕對LDL-C減少越大,CV風險減少越大。與LDL-C降低相關的好處不僅僅適用於他汀療法。還未明確定義LDL-C的任何水平,其中好處停止或出現危害。
對飲食和藥物治療的LDL-C反應存在相當大的個體差異,這通常被視為支持定制治療方法的依據。總CV風險減少應該個性化,如果制定了目標,則可以更具體。使用目標也可以幫助醫生與患者的溝通。人們認為,目標方法可能有助於遵循治療,盡管這種共識觀點尚未得到充分驗證。基於所有這些原因,歐洲工作組保留了脂質管理的目標方法,並且治療目標根據總CV風險水平進行了定制。還有證據表明,降低LDL-C超出以前EAS/ESC指南中設定的目標與較少的ASCVD事件相關。因此,至少在極高CV風險的患者中,降低LDL-C至盡可能低的水平似乎是合適的,出於這個原因,建議至少降低50%的LDL,並達到定制目標。
脂質目標是綜合CV風險降低策略的一部分,摘要如表7所示。非脂質目標的理由在2016年ESC聯合預防指南中給出。
表7 心血管疾病預防的治療目標和目標
脂質管理的有針對性方法主要旨在通過大規模的PCSK-9抑制劑試驗中實現的LDL-C水平大幅降低,以大幅降低動脈粥樣硬化風險。因此,對於非常高心血管風險的患者,無論是在二級預防還是(很少)在初級預防中,建議從基線降低LDL-C≥50%,並將LDL-C目標設定為<1.4 mmol/L (<55 mg/dL)。對於已經在服用最大可耐受的他汀類治療的情況下,在2年內經歷第二次血管事件的ASCVD患者(不一定是與第一次事件相同的類型),可以考慮將LDL-C目標設定為<1.0 mmol/L (<40 mg/dL)。對於高心血管風險的人群,建議從基線降低LDL-C≥50%,並將LDL-C目標設定為<1.8 mmol/L (<70 mg/dL)。對於中度心血管風險的患者,應考慮將LDL-C目標設定為<2.6 mmol/L (<100 mg/dL),而對於低風險個體,可以考慮設定<3.0 mmol/L (<116 mg/dL)的目標(參見下面的低密度脂蛋白膽固醇治療目標建議和附表2)。
次要目標也已經根據推斷為非HDL-C和ApoB制定,它們獲得了中等評級,因為它們在RCTs中尚未得到廣泛研究。非HDL-C的具體目標應該比相應的LDL-C目標高0.8 mmol/L(30 mg/dL);在達到LDL-C目標後,可以考慮根據這些次要目標調整降脂療法,儘管這種方法在結果方面的臨床優勢尚待討論。當使用次要目標時,建議如下:(i)非HDL-C分別應在非常高、高和中等心血管風險人群中為<2.2 mmol/L(<85 mg/dL),<2.6 mmol/L(<100 mg/dL)和<3.4 mmol/L(<130 mg/dL);121–123,以及(ii)ApoB分別應在非常高、高和中等總心血管風險人群中為<65 mg/dL、<80 mg/dL和<100 mg/dL。121,123,124
迄今為止,尚未在臨床試驗中確定高密度脂蛋白膽固醇(HDL-C)或三酸甘油脂(TG)水平的特定目標,儘管HDL-C的增加預測動脈粥樣硬化的逆轉,而低HDL-C與冠狀動脈疾病(CAD)患者中的多餘事件和死亡有關,即使在低LDL水平下也是如此。在考慮進一步加強治療高或非常高總心血管風險患者時,臨床醫師應運用臨床判斷。
7. 改善血漿脂質概況的生活方式修改
在預防冠心病和中風的過程中,營養在其中扮演了至關重要的角色。125–129飲食因素直接或通過對傳統風險因素(如血漿脂質、血壓或血糖水平)的影響,對心血管疾病的發展產生影響。
然而,有關飲食與冠心病和中風風險之間因果聯繫的令人信服的證據是間接的,來自隨機的“代謝病房”研究,顯示高飽和脂肪攝入量導致LDL-C濃度升高,以及來自群體研究、遺傳流行病學研究和隨機試驗,顯示較高的LDL-C水平導致冠心病和中風。
研究之間缺乏一致性,既是由於方法學問題(特別是樣本量不足或研究持續時間短)所致,也是由於評估飲食中的單一因素對健康影響獨立於飲食中的其他任何變化的困難。事實上,由於食物是不同營養素和其他成分的混合物,將一種食物的健康效應歸因於其中一種成分是不適當的。此外,如果能量攝入必須保持不變,減少一種宏量營養素的攝入量必然意味著增加其他宏量營養素的攝入量。所替代的品質(例如,不飽和脂肪與高度精製的穀物)可能會影響觀察到的效應,從而顯著改變所替代營養素對健康的影響。這些限制提示在解釋關於單一飲食變化對冠心病和中風的影響的RCT結果,甚至在解釋關於單一飲食變化對ASCVD的影響的Meta分析結果時,要謹慎。130
為了克服至少部分這些問題,近年來的營養研究已專注於一方面是冠心病和中風,另一方面是食物和飲食模式,而不是單一營養素的關係。來自流行病學研究的一致證據表明,高水果、非澱粉蔬菜、堅果、豆類、魚、植物油、酸奶和全穀物的攝入量增加,以及對紅肉和加工肉類、富含精製碳水化合物和鹽分的攝入量減少,與心血管事件的發生率降低相關。此外,這表明用植物脂肪和多不飽和脂肪酸(PUFAs)替代動物脂肪,包括乳脂肪,可能減少心血管疾病的風險。132
經過更廣泛評估的飲食模式包括“停止高血壓的膳食方法”(DASH)飲食,特別是在控制血壓方面,以及地中海飲食;這兩者已被證明在降低心血管風險因素方面是有效的,可能有助於預防冠心病和中風。133地中海飲食和DASH飲食之間最重要的差異在於前者對特級初榨橄欖油的重視。流行病學研究表明,地中海飲食與心血管和其他非傳染性疾病的發生率降低相關,並且在隨機試驗中已被證明在初級和二級預防中降低心血管事件的有效性。特別是,“地中海飲食預防研究”(PREDIMED)試驗表明,分配到地中海式飲食,並添加特級初榨橄欖油或堅果的參與者,與那些低脂飲食的參與者相比,主要心血管事件的發生率顯著降低(約30%)。137
總之,儘管PREDIMED和其他一些以ASCVD結局為目標的干預研究支持健康的生活方式用於預防冠心病和中風,但RCT不能成為飲食建議的唯一基礎。它們還需要基於大規模的觀察性隨訪研究和相對短期的隨機試驗,並以中間風險因素(如血脂)作為結局的依據。
表8總結了目前有關生活方式改變和功能性食品對脂蛋白影響的證據,指出了效應的幅度和與特定脂蛋白類的影響相關的證據水平;由於上述原因,證據水平不是基於具有ASCVD結局的RCTs。此外,在關於藉著飲食手段改善血漿脂蛋白概況的指南中,即使在缺乏明確的CV益處證明的情況下,也提供了有關這種潛力的信息。
表8 特定生活方式改變對脂質水平的影響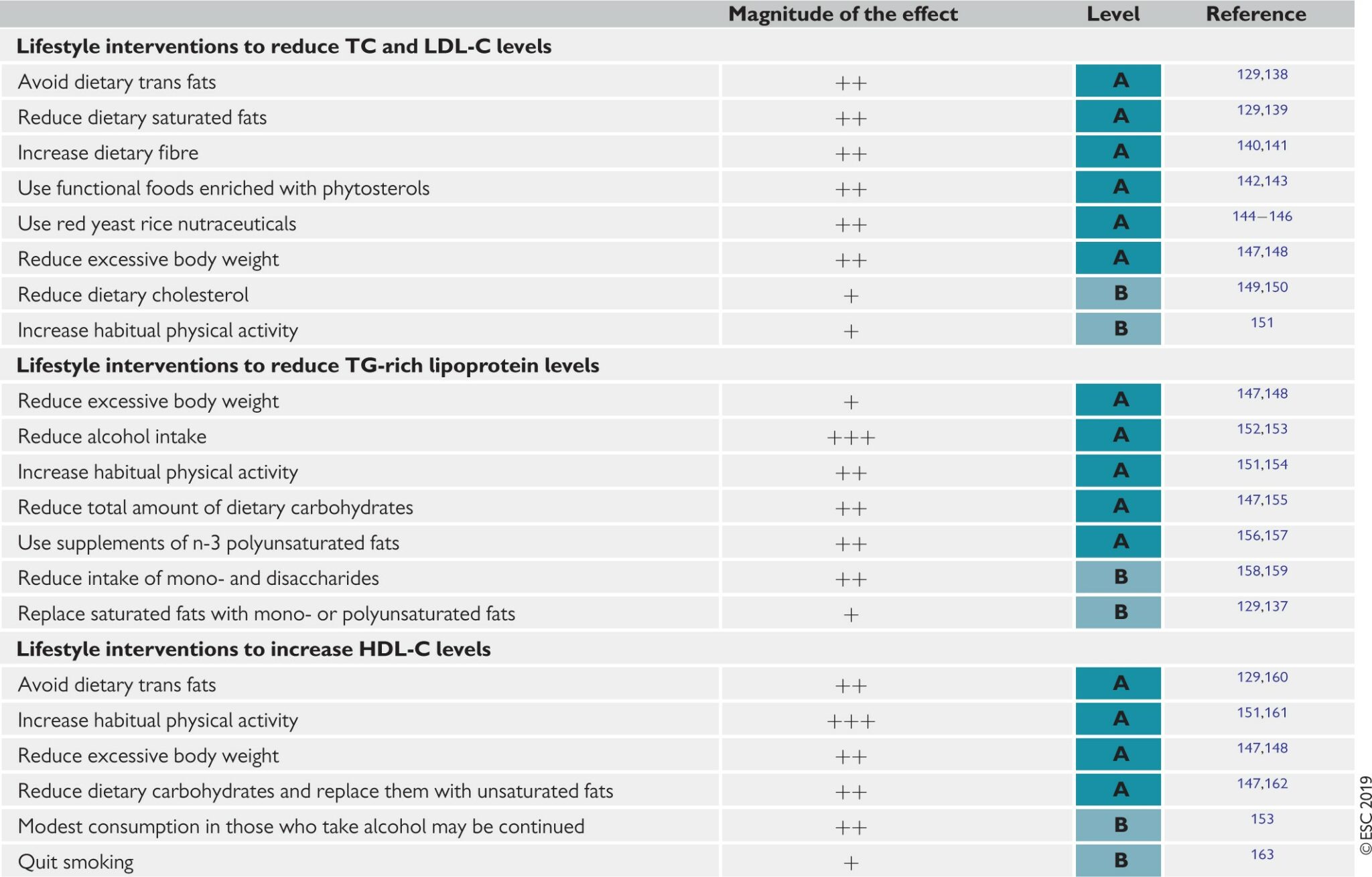
7.1 生活方式對總膽固醇和低密度脂蛋白膽固醇水平的影響
飽和脂肪酸(SFAs)是對LDL-C水平影響最大的膳食因素(每增加1%來自飽和脂肪的能量,LDL-C增加0.02–0.04 mmol/L或0.8–1.6 mg/dL)。164 在定量上,膳食反式脂肪酸對LDL-C的升高效果與SFAs相似;然而,雖然SFAs增加HDL-C水平,但反式脂肪降低HDL-C水平。137 反式不飽和脂肪酸通常以有限量(通常<5%的總脂肪)存在於乳製品和反芻動物的肉類中。工業來源的“部分氫化脂肪酸”代表了飲食中反式脂肪酸的主要來源;不同人群中的反式脂肪酸平均攝入量在總能量攝入中佔0.2–6.5%。165 當用含有不飽和脂肪酸的油(如紅花、向日葵、菜籽、亞麻籽、玉米、橄欖或大豆)替代富含SFAs的食物(如黃油或豬油)時,可以降低LDL-C水平(-0.42至-0.20 mmol/L)。166 糖的攝入對LDL-C的影響在第7.4.3節中有描述。
體重減少也會影響TC和LDL-C水平,但效應的幅度很小:在肥胖的人中,每減少10公斤體重,LDL-C濃度降低0.2 mmol/L(8 mg/dL)。147,167 正規的體育運動引起的LDL-C水平下降更小。151,168 體重減輕和體育運動對心血管風險概況的好處可能會影響其他風險因素,特別是高血壓和糖尿病。
表9總結了降低TC和LDL-C水平的可能食物選擇。鑒於歐洲人口的文化多樣性,應將這些建議轉化為實際行為,考慮當地的習慣和社會經濟因素。
表9 降低低密度脂蛋白膽固醇並改善總脂蛋白概況的食物選擇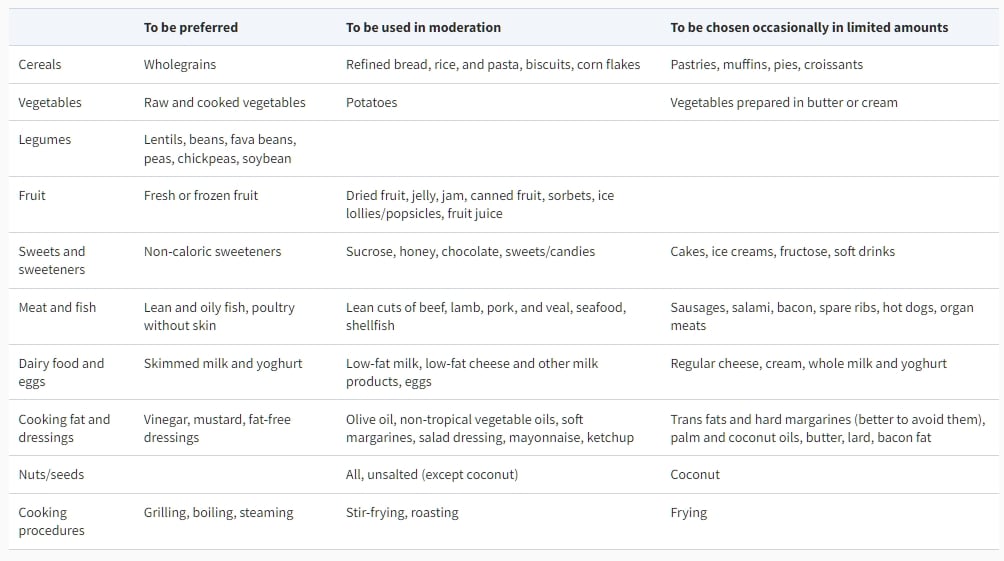
7.2 生活方式對三酸甘油脂水平的影響
體重減輕改善胰島素敏感性並降低三酸甘油脂水平。定期的體育運動減少了血漿三酸甘油脂水平,超出了體重減輕的效應。151,168,169 酒精攝入對三酸甘油脂水平有重大影響,特別是對HTG患者。153,170 高碳水化合物飲食對三酸甘油脂的不良影響主要出現在消耗富含精製碳水化合物的食物時,如果飲食主要基於富含纖維、低血糖指數的食物,這些影響要小得多。這特別適用於糖尿病或代謝綜合症的人。171,172
習慣性攝入大量(>10%能量)的蔗糖有助於提高三酸甘油脂水平,特別是對於患有HTG或腹部肥胖的人。這些效應是劑量依賴性的;當習慣性攝入蔗糖佔總能量攝入的15–20%時,血漿三酸甘油脂增加可達30–40%。蔗糖是一種含有葡萄糖和蔗糖的雙糖,代表了飲食中蔗糖的重要來源。159,173,174
7.3 生活方式對高密度脂蛋白膽固醇水平的影響
體重減輕增加高密度脂蛋白膽固醇(HDL-C)水平;當體重減輕穩定下來時,每減少1公斤體重,HDL-C水平增加0.01 mmol/L(0.4 mg/dL)。有氧運動,如每週25–30公里的快走(或任何等效的活動),可能會增加HDL-C水平0.08–0.15 mmol/L(3.1–6 mg/dL)。169 戒菸也可能有助於提高HDL-C水平,前提是防止體重增加。163
7.4 改善血漿脂質概況的生活方式建議
降低低密度脂蛋白膽固醇(LDL-C)水平代表減少心血管風險的主要目標,因此在評估生活方式措施時應特別強調。建議適用於一般人口,特別是對於增加心血管風險的人,也可能能夠調整血漿三酸甘油脂和HDL-C水平(表9)。本節重點關注可能實施以改善總脂蛋白概況的飲食和其他生活方式因素。
5.4.1 脂蛋白的測量
7.4.1 體重和身體活動
由於超重、肥胖,尤其是腹部脂肪過多,通常會導致脂質異常,因此在那些體重過重和/或腹部脂肪過多的人中,應減少熱量攝入,增加能量消耗。
在超重的情況下,即使體重減輕(基礎體重的5-10%),也能改善脂質異常並有利於其他脂質異常患者常見的心血管風險因素。148 雖然體重減輕對代謝和代用指標的有益影響已被證明,但體重減輕對死亡率和心血管結局的益處較不明確。175
體重減輕可通過減少高熱量食物的攝入,引起每天熱量不足300-500千卡。干預應結合飲食和運動;這種方法還能夠最大程度地改善身體表現和生活質量,減輕肌肉和骨質損失,特別是在老年人中。176 始終適合建議脂質異常患者每天進行中等強度的定期體育鍛煉,即使他們沒有超重。168
7.4.2 飲食脂肪
避免食用反式脂肪是預防心血管疾病的重要措施。植物油部分氫化過程中產生的反式脂肪酸佔總攝入量的80%。多虧了世界各地的努力,過去10-15年中,反式脂肪酸的攝入量已大幅減少。
至於飽和脂肪,其攝入量應低於總熱量攝入的10%,在高膽固醇血症的情況下應進一步減少(能量的7%以下)。對於大多數個人來說,接受一定範圍的總脂肪攝入是可以接受的,這將取決於個人的喜好和特徵。但是,脂肪攝入量>35-40%的卡路里通常與飽和脂肪和熱量的攝入增加有關。相反,低脂肪和油的攝入量會增加維生素E和必需脂肪酸攝入不足的風險,並可能導致HDL-C減少。164
脂肪攝入應主要來自單不飽和脂肪酸的來源,包括n-6和n-3多不飽和脂肪酸。目前尚無足夠的數據可以對n-3:n-6脂肪酸的最佳比例提出建議。177,178 飲食中的膽固醇攝入應減少(<300毫克/天),特別是在血脂較高的人中。
7.4.3 飲食中的碳水化合物和纖維
飲食中的碳水化合物對LDL-C具有“中性”影響,盡管過度攝入會對血漿三酸甘油酯和HDL-C水平產生不良影響。164 膳食纖維(尤其是可溶性纖維)——存在於豆類、水果、蔬菜和全穀物(如燕麥和大麥)中——對降膽固醇具有作用,是飲食中飽和脂肪的良好替代品,可以最大程度地提高飲食對LDL-C水平的影響,並最大程度地減小高碳水化合物飲食對其他脂蛋白的不良影響。140,179
碳水化合物攝入應在總能量攝入的45-55%之間,因為較高和較低百分比的碳水化合物飲食均與增加的死亡率有關。180,181 提供每天25-40克總膳食纖維,包括≥7-13克可溶性纖維的脂質調整飲食在控制血漿脂質方面耐受性好且有效,建議使用;相反,無法理解對極低碳水化合物飲食的建議。182
添加糖的攝入量不應超過總能量的10%(除了天然食品中含有的糖,如水果和乳製品);對於需要減重或血漿三酸甘油酯值較高、代謝綜合症或糖尿病的人,關於糖的更嚴格建議可能有用。一般人口應適度飲用軟飲料,但在三酸甘油酯值升高或內臟脂肪過多的人中,應嚴格限制軟飲料的攝入。158,159,174 Prospective Urban Rural Epidemiology (PURE) 研究是一項大規模的流行病學群體研究,納入了18個國家的135,335名參與者,記錄了飲食頻率問卷。總脂肪和脂肪類型與CVD、MI或CVD死亡無關,而飽和脂肪與中風呈負相關。181 然而,包括PURE研究在內的流行病學研究的荟萃分析顯示碳水化合物攝入量與死亡率呈U形關係:與最高死亡率相關的飲食中碳水化合物攝入量>70%和<40%的能量,當碳水化合物攝入量在總能量攝入的45-55%之間時,風險最低。180
7.4.4 酒精
對於飲酒者,適度的酒精攝入量(每天≤10克(1單位)男女皆可)是可以接受的,如果三酸甘油酯水平未升高的話。183,184
7.4.5 吸煙
戒煙對總體心血管風險,尤其是HDL-C水平,有明顯的好處。163
7.5 用於治療脂質代謝異常的膳食補充劑和功能性食品
功能性食品的營養評估不僅包括尋找與改善健康或降低疾病風險相關的有益效果的臨床證據,還包括展示良好的耐受性。總的來說,迄今在這一領域已經確定的功能性食品的證據還不完整;主要的缺陷是缺乏足夠長時間的基於飲食的干預試驗,以對脂質代謝異常和心血管疾病的自然發展具有相關性。
7.5.1 植物固醇
主要的植物固醇包括豆甾醇、豆甾酮和甾醇;它們在植物油中自然存在,在蔬菜、新鮮水果、堅果、穀物和豆類中含量較少。植物固醇的膳食攝入量在北歐平均為250毫克/天,地中海國家約為500毫克/天。植物固醇與膽固醇競爭腸道吸收,從而調節總膽固醇水平。
每天攝入2克植物固醇可以有效降低人體總膽固醇和LDL-C水平7-10%(不同個體之間存在一定程度的異質性),但對HDL-C和三酸甘油酯水平幾乎沒有影響。143 然而,到目前為止,尚未進行有關其對CVD的後續影響的研究。基於降低LDL-C且無不良信號,具有植物固醇/固醇醇(主餐時每日≥2克)的功能性食品可能被考慮:(i)對於具有中等或低全球CV風險但不符合藥物治療標準的高膽固醇水平的個體;(ii)作為高風險和非常高風險患者的藥物治療的輔助,他們在他汀類藥物上未能達到LDL-C目標或無法接受他汀類藥物治療;以及(iii)根據目前的指南,用於成人和兒童(年齡> 6歲)的FH患者。142
7.5.2 莫納科林和紅曲米
紅曲米(RYR)是一種發酵色素來源,已在中國用作食品著色劑和增味劑數個世紀。RYR的降膽固醇效應與一種類似於他汀類藥物的機制有關 – 即單寧素的羥甲戊二酸輔酶A(HMG-CoA)還原酶抑制作用,單寧素代表了生物活性成分。不同商業配製的RYR具有不同濃度的單寧素,對TC和LDL-C水平的影響程度也不同,但消費者無法進行區分。144,185 此外,長期食用這些產品的安全性尚未完全記錄,由於某些製劑可能含有污染物,已提出了安全問題。也報告了與他汀類藥物相似的副作用。
在唯一可用的RCT中,對於存在ASCVD的患者,RYR的部分純化提取物降低了復發事件45%。146 使用提供每日(omni die)2.5-10毫克單寧K的RYR製劑觀察到具有臨床相關的降膽固醇效應(高達20%的降低)。145 含有純化RYR的保健食品可以考慮用於具有升高的血漿膽固醇濃度但不符合全球CV風險治療標準的人。然而,迫切需要更好地監管RYR補充劑。應實施有關這些產品的確切成分、其成分的量以及其純度的信息。185
7.5.3 膳食纖維
現有證據一致表明,燕麥和大麥中的黏性纖維β-葡聚醣對總膽固醇和LDL-C有降低作用。富含這些纖維或補充劑的食品耐受性好,有效,並建議用於降低LDL-C。然而,要實現3-5%的LDL-C水平的臨床相關降低所需的劑量根據特定類型的纖維不同,範圍從每天3-10克。187
7.5.4 大豆
大豆的降膽固醇效應通常歸因於其異黃酮和植物雌激素含量,其隨著大豆處理程度的增加逐漸減少。當取代動物蛋白質食品時,大豆蛋白質也被認為能夠引起輕微的LDL-C降低效應。但是,在考慮其他膳食成分的變化時,未能確認這一點。187,188
7.5.5 聚山梨醇和小檗鹼
聚山梨醇是一種從甘蔗蠟中提取的長鏈脂肪醇的天然混合物。189 研究表明,來自甘蔗、大米或小麥胚芽的聚山梨醇對LDL-C、HDL-C、TG、ApoB、Lp(a)、同型半胱氨酸、高敏感性C-反應蛋白、纖維蛋白原或血凝血因子水平均沒有顯著影響。190
至於小檗鹼,最近的一項荟萃分析評估了其對人體血脂的影響。191 對小檗鹼和生活方式干預或安慰劑的比較評估表明,在小檗鹼組中,LDL-C和血漿TG水平的降低效果優於對照組。然而,由於缺乏高質量的隨機臨床試驗,小檗鹼用於治療血脂異常的功效需要進一步驗證。此外,不同小檗鹼製劑的生物利用度存在爭議。187
7.5.6 n-3不飽和脂肪酸
觀察性證據表明,消費魚類(至少每週兩次)和富含n-3脂肪酸的植物食品(α-亞麻酸存在於核桃、一些蔬菜和一些種子油中)與心血管死亡和中風的風險較低有關,但對血漿脂蛋白代謝沒有主要影響。178,192 長鏈n-3脂肪酸(2-3克/天)的藥理劑量可以使TG水平降低約30%,還可以減少進餐後的脂質反應,但更高的劑量可能會增加LDL-C水平。α-亞麻酸對改變TG水平的效果較差。156,193 最近,在使用來普利二乙酯每天兩次治療TG水平升高的患者中,觀察到缺血事件(包括心血管死亡)的風險顯著降低。194
有助於預防心血管疾病的健康飲食的其他特點請參閱附加數據。
8 用於治療血脂異常的藥物
8.1 他汀類藥物
8.1.1 作用機制
他汀類藥物通過競爭性抑制肝臟中的HMG-CoA還原酶酶,這是膽固醇生物合成的速率限制步驟,來降低肝臟中膽固醇的合成。細胞內膽固醇的減少促使肝細胞表面的LDL受體(LDLR)表達增加,進而導致LDL從血液中的攝取增加,降低了LDL-C和其他包含ApoB的脂蛋白,包括TG豐富的粒子的血漿濃度。
8.1.2 對脂質的影響
8.1.2.1 低密度脂蛋白膽固醇。
LDL-C的減少程度取決於劑量,並且在不同的他汀類藥物之間有所不同。高強度療法定義為預期平均降低LDL-C≥50%的他汀藥物劑量;中度強度治療定義為預期降低LDL-C 30-50%的劑量。值得注意的是,同樣劑量的藥物對LDL-C的降低在不同個體之間存在相當大的差異。31 臨床研究中對他汀類藥物治療的反應不佳,在一定程度上是由於服藥不當引起的,但也可能是由基因背景解釋的。195,196 他汀類藥物反應的個體間差異需要在治療開始時監測反應。
對於由於不良反應而無法耐受推薦的他汀藥物劑量或未能達到治療目標的患者,建議在最大可耐受的他汀藥物上添加一種非他汀藥物來調整脂質。197,198
8.1.2.2 三酸甘油酯。
他汀類藥物通常可以使三酸甘油酯水平從基線值降低10-20%。199 更強效的他汀藥物(阿托伐他汀、羅伊司他汀和匹伐他汀)在高劑量和三酸甘油酯升高的患者(HTG)中,特別是在高劑量和三酸甘油酯升高的患者(HTG)中,表現出強有力的三酸甘油酯降低作用,其中絕對風險,因此絕對風險減少更大。
三酸甘油酯降低作用的機制尚未完全阐明,但似乎在某種程度上獨立於LDLR途徑。它可能涉及肝細胞對VLDL的攝取的上調,以及VLDL的產生速率的降低;這些效應似乎取決於預處理VLDL濃度。200
8.1.2.3 高密度脂蛋白膽固醇。
在一項荟萃分析中,201 不同他汀藥物的HDL-C水平提高隨劑量而有所不同;這些提高幅度在1-10%之間。然而,鑒於他汀藥物對致動脈粥樣ApoB-containing脂蛋白的明顯降低作用,很難確定HDL-C水平的這種非常有限的影響可能對他汀干預試驗中一直觀察到的整體CV風險降低有多大貢獻。
8.1.2.4 脂蛋白(a)。
他汀類藥物只會輕微影響Lp(a)的血漿水平。以前的研究報告在他汀藥物治療後要麼對Lp(a)水平沒有影響,要麼導致Lp(a)水平升高。202,203 他汀藥物提升Lp(a)上氧化磷脂的機制需要進一步研究。
8.1.3 他汀類藥物的其他效應
儘管降低LDL-C水平是他汀類藥物的主要效應,但已提出了一些其他可能重要的效應(他汀類藥物的多重效應)。204,205 這些效應中,對抗炎症和抗氧化作用是對他汀類藥物治療可能對CVD預防有關的效應。這些效應在體外和實驗系統中已經證明,但其臨床相關性尚未得到證實。18,206
8.1.3.1 對心血管發病率和死亡的影響。
已經進行了大量的荟萃分析,以分析他汀類藥物在不同人群和亞組中的效果。34-36,38,51,207-214 在膽固醇治療試驗者(CTT)的荟萃分析中,包括來自26個隨機對照試驗的> 170,000名參與者的個體參與者數據(IPD),比較了他汀藥物與對照組或更多強度的他汀藥物劑量的效果,34每降低1 mmol/L的LDL-C,他汀/更多他汀藥物降低主要血管事件(心肌梗塞,冠心病死亡,或任何中風或冠狀動脈再血管化)約22%,降低主要冠狀事件23%,冠心病死亡20%,總中風17%,總死亡10%在5年內。對主要血管事件的比例效應(每mmol/L降低的LDL-C)在檢驗的所有亞組中都相似,因此絕對風險降低與絕對基線風險成正比。相對效益在第一年與隨後年份相比是一半。分配他汀藥物的患者中沒有任何非CV死亡原因的風險增加,包括癌症在內。他汀藥物治療的絕對效益在一般風險較低的一次預防患者中較低。36,38,214,215 在對心血管疾病風險低的人群中,每mmol/L降低LDL-C的主要血管事件相對風險降低至少與低風險個體(即主要預防)一樣大。在沒有血管疾病病史的患者中,他汀治療每mmol/L降低LDL膽固醇可以降低全因死亡風險9%。2013年的Cochrane綜述也報告了類似的結果。213 最近對West of Scotland冠心病預防研究(WOSCOPS)數據進行了重新分析,並且顯示即使沒有DM且10年預測的ASCVD風險低於7.5%的人也受益於他汀治療。在20年內,全因死亡有18%的死亡益處。216 他汀藥物對老年人,包括年齡>75歲的老年人,預防ASCVD是有效的。217 他汀藥物對一些特定的患者組無效,特別是那些患有心臟衰竭(HF)或接受血液透析的患者。214,218-222
目前的荟萃分析可用證據表明,他汀治療的臨床益處主要是一個藥物類別效應,由LDL-C降低的絕對效益所驅動;因此,所選擇的他汀藥物應反映了給定患者的治療目標。
可以提出以下方案。
評估個體的總CV風險。
確定治療目標(根據當前風險)。
讓患者參與CV風險管理的決策。
選擇一種他汀藥物方案,並在必要時選擇其他治療方法(例如依智脂或PCSK9抑制劑),以滿足治療目標(百分比和絕對值)。
他汀藥物治療的反應是可變的,因此在開始其他降低LDL的治療之前,可能需要提高他汀藥物的劑量。
這些是選擇藥物的一般標準。患者的臨床狀況,伴隨用藥,藥物耐受性,當地治療傳統和藥物費用等因素將在確定最終藥物和劑量的選擇中發揮重要作用。
此外,他汀藥物對一些其他臨床疾病的影響也已經得到評估。對於癌症,一項隨機試驗的IPD的荟萃分析表明,他汀藥物在至少約5年的時間內對癌症沒有任何顯著影響。223 其他條件,如失智症,肝臟脂肪變性,靜脈血栓栓塞症,心房顫動和多囊卵巢綜合症也已被研究,並且對這些條件的他汀藥物影響尚未得到可靠的證實。最近的一項Cochrane分析已經檢視了他汀對阿爾茨海默病的作用,並未報告他汀藥物有任何明確的效應。230 此外,對於在高心血管風險受試者(EBBINGHAUS)研究中隨機分配給PCSK9單克隆抗體的他汀治療方案的患者,神經認知功能進行了廣泛的研究,並且在那些接受他汀治療的患者中沒有觀察到超額風險。231
8.1.4 他汀類藥物的不良反應和相互作用
他汀藥物在吸收、生物利用度、血漿蛋白結合、排泄和親脂性方面存在差異。通常建議晚上給藥。洛伐他汀和席伐他汀是前藥,而其他可用的他汀藥物以其活性形式給藥。由於在肝臟中首次通過作用,他們的生物利用度相對較低,許多他汀藥物通過經過肝臟的細胞色素P450(CYP)同工酶進行顯著的肝代謝,除了普伐他汀,羅伊伐他汀和皮塔伐他汀。這些酶主要在肝臟和腸道壁中表達。儘管他汀藥物通常非常耐受,但它們確實對肌肉、葡萄糖平衡和出血性中風有一些特定的不良反應。但最近的綜述也指出,對潛在不良反應存在廣泛的誤解。232,233
8.1.4.1 對肌肉的不良影響。
肌肉病是他汀藥物最具臨床意義的不良反應。在肌肉病的風險因素中,特別重要的是要考慮與同時使用其他藥物治療的相互作用(見下文)。橫紋肌溶解症是他汀藥物引起的肌肉損害的最嚴重形式,其特徵是嚴重的肌肉疼痛、肌肉壞死和可能導致腎功能衰竭和死亡的肌紅蛋白尿。在橫紋肌溶解症中,肌酸激酶(CK)水平升高≥10倍,通常≥40倍,正常上限(ULN)。234 橫紋肌溶解症的發生率估計代表了每100,000名患者年約1-3例。235 接受他汀治療的患者經常報告肌肉症狀[所謂的’與他汀相關的肌肉症狀’(SAMS)],在非隨機觀察性研究中,他汀藥物與肌肉疼痛和嚴重功能損失無關的肌肉疼痛和嚴重功能損失相關(肌肉疼痛),在此類研究中報告的SAMS的頻率在接受他汀治療的個體中變化在10-15%之間。236-238 然而,部分原因是因為觀察性研究中的個體不知道他們正在接受的治療,所以當用於評估他汀藥物的不良反應時,此類研究是不可靠的。233 相反,在他汀藥物與安慰劑的盲法隨機試驗中,他汀分配組的肌肉症狀頻率沒有增加,或者僅稍微增加。239,240 安格洛-斯堪的納維亞心臟結局試驗 – 降低血脂療法(ASCOT-LLA)研究在這個問題上提出了比較四種不同不良事件,包括與肌肉有關的症狀,在盲法、安慰劑對照試驗及其開放性擴展研究期間的發生率。238 他們得出的結論是,安慰劑組中SAMS的頻率在觀察性研究中比在試驗中高的部分原因可能是由於負面預期引起的惡劣效應。建議對肌肉症狀的實際管理請參見附圖6。198,234,241 一些研究顯示,每隔一天或每週兩次的給藥方式,如阿托伐他汀或羅伊伐他汀,具有相當大的LDL-C降低作用。242 盡管沒有可用的臨床結局試驗,但在高風險患者中,應考慮此策略,其中無法使用每日劑量的他汀治療。
8.1.4.2 對肝臟的不良影響。
血漿中丙氨酸氨基轉移酶(ALT)的活性通常用於評估肝細胞損傷。輕度ALT升高在接受他汀治療的患者中發生率為0.5-2.0%,在強效他汀或高劑量下更常見。通常的臨床相關ALT升高的定義是連續兩次增加三倍于ULN。輕度ALT升高未顯示與真正的肝毒性或肝功能改變相關聯。進展為肝功能衰竭的情況極為罕見,因此不再建議在他汀治療期間定期監測ALT。243 由於脂肪肝病引起的輕度ALT升高已在接受他汀治療的期間進行研究,並且沒有跡象表明他汀藥物會加重肝病。244-246
8.1.4.3 增加新發糖尿病的風險。
已經證明接受他汀治療的患者存在發展代謝異常和2型糖尿病(T2DM)的風險增加。多項研究表明,這是一種一致的、與劑量相關的效應。232 還觀察到輕度的、不具臨床意義的糖化血紅蛋白(HbA1c)升高。估計在4年的他汀治療期間,引起一例糖尿病的需要數為255。247 但是,更強效的他汀藥物在高劑量下的風險更高,248 老年患者以及存在其他糖尿病風險因素(如超重或胰島素抵抗)的情況下風險也較高。249 總的來說,在高風險患者中,心血管疾病的風險絕對降低明顯超過了糖尿病發病率輕微增加的可能不良影響。233 這種效應可能與他汀藥物的作用機制有關,因為Mendelian隨機化研究已經確認了具有HMG-CoA還原酶多態性的人中發生DM風險增加。250
8.1.4.4 增加出血性中風的風險。
在觀察性研究中,總膽固醇與出血性中風呈負相關,在CTT的荟萃分析中,每降低1 mmol/L的LDL膽固醇出血性中風的相對風險增加了21%(95%置信區間5-41%;P=0.01)。34,251,252 但是,其他荟萃分析的結果互相矛盾,有必要進一步探討特定類型患者的出血性中風風險。然而,需要注意的是,整體上對其他中風亞型的好處遠遠超過了這種小(且不確定)的風險。34,36
8.1.4.5 對腎功能的不良影響。
目前沒有明確的證據表明他汀藥物對腎功能有臨床意義的有益或不良影響。253 對所有他汀藥物都報告了蛋白尿的增加頻率,但對于羅伊伐他汀進行了更詳細的分析。使用80 mg劑量時,報告了12%的頻率。在批准的<40 mg劑量下,頻率要低得多,與其他他汀藥物的頻率相符。由他汀藥物引起的蛋白尿來自小管,通常是暫時的,據信是由於小管重吸收減少而不是由於腎小球功能障礙引起的。254,255 在臨床試驗中,蛋白尿的頻率通常很低,而且在大多數情況下,不會比安慰劑高。256
8.1.4.6 互動。
已經描述了與他汀藥物相關的一些重要藥物相互作用,可能會增加不良反應的風險。在表10中總結了參與他汀代謝的酶途徑的抑制劑和誘導劑。除了普拉伐他汀、羅伊伐他汀和匹伐他汀之外,所有當前可用的他汀藥物均經過CYPs的主要肝代謝。這些異構酶主要在肝臟和腸道中表達。普拉伐他汀不通過CYP系統代謝,但通過磺化和共軛代謝代謝。CYP3A4異構酶是最豐富的,但其他異構酶,如CYP2C8、CYP2C9、CYP2C19和CYP2D6,也經常參與他汀藥物的代謝。因此,這些CYP的其他藥理基質可能會干擾他汀藥物的代謝。相反,他汀治療可能會干擾其他藥物的分解,這些藥物通過相同的酶系統代謝。
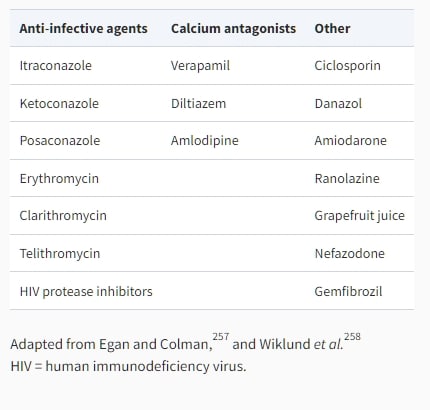
將他汀藥物與吉非贝特結合會增加患肌無力風險,必須避免與他汀藥物一併使用。當將他汀藥物與其他纖維酸酯藥物(如芬費布特、貝扎費布特或西普費布特)結合使用時,幾乎不會增加患肌無力的風險。
8.2 膽固醇吸收抑制劑
8.2.1 作用機制
伊普利米布(Ezetimibe)在腸道細胞的刷狀緣(brush border)水平上通過與尼曼-皮克C1樣蛋白1(NPC1L1)相互作用,抑制腸道對膳食和膽固醇的吸收,而不影響脂溶性營養物質的吸收。通過抑制膽固醇的吸收,伊普利米布降低了傳遞到肝臟的膽固醇量。由於降低的膽固醇傳遞,肝臟會通過上調LDL受體(LDLR)的表達來應對,進而增加了LDL從血液中的清除。
8.2.2 對脂質的影響
在臨床研究中,伊普利米布單獨使用每天10毫克,可以使高膽固醇患者的LDL-C降低15-22%,但存在較高的個體間差異。一項包括超過2700名參與者的隨機對照試驗的荟萃分析顯示,與安慰劑相比,伊普利米布可以使LDL-C降低18.5%。此外,伊普利米布還使HDL-C顯著增加3%,TGs顯著降低8%,TC降低13%。
在正在接受他汀藥物治療的患者中,伊普利米布可以使LDL-C水平額外降低21-27%,相較於安慰劑,無論是否存在已建立的冠心病。在他汀藥物未曾使用的患者中,伊普利米布和他汀藥物的結合治療相較於單獨使用相同的他汀藥物和劑量,可以使LDL-C更額外降低約15%。在其他研究中,這種組合還在與增加他汀藥物劑量(13-20%)相比,以及從他汀藥物單獨治療轉換到伊普利米布和他汀藥物組合治療之後(11-15%)顯著改善了LDL-C水平的降低。263
伊普利米布與膽酸螯合劑(科列司維、科列司酚或胆酸螯合劑)聯合使用報導稱,與穩定的胆酸螯合劑治療方案相比,可以使LDL-C水平額外降低10-20%。264 伊普利米布與PCSK9抑制劑聯合使用也會產生額外的效果。265
8.2.3 對心血管發病和死亡率的影響
Ezetimibe 聯合西伐他汀治療在主動脈狹窄患者中的效力在《主動脈狹窄西伐他汀和伊普利米布(SEAS)試驗》266 和慢性腎臟病患者中的效力在《心臟和腎臟保護研究(SHARP)試驗》222 中已經得到探討。在SEAS和SHARP試驗中,與安慰劑相比,在西伐他汀-伊普利米布組中顯示出心血管事件的減少。266,267
在《改善結果:Vytorin國際試驗(IMPROVE-IT)》中,將伊普利米布添加到急性冠狀症候群(ACS)患者的西伐他汀(40毫克)治療中。33 總共有18,144名患者被隨機分配接受他汀或他汀加伊普利米布治療,並有7年內有5314名患者發生了心血管事件;在服用西伐他汀加伊普利米布組的患者中,發生的事件較少(32.7% vs. 34.7%),這相當於減少了170個事件(P=0.016)。研究期間的平均LDL-C分別為西伐他汀組1.8 mmol/L(70 mg/dL)和伊普利米布加西伐他汀組1.4 mmol/L(55 mg/dL)。此外,這項試驗中的缺血性中風減少了21%(P=0.008)。並未發現伊普利米布或進一步降低LDL-C引起的任何有害效應。在這組已經接受他汀治療以達到目標的患者中,由伊普利米布增加的絕對心血管益處很小,雖然顯著,但與CTT的預期相符。268 因此,該研究支持了除他汀以外的其他方法降低LDL-C的效益和安全性的主張。遺傳研究也支持了伊普利米布的有益效果;已經發現,失活這種蛋白質的自然發生突變與血漿LDL-C的降低以及冠心病風險的降低有關。55,269,270
與其他研究一起,271 IMPROVE-IT支持了伊普利米布應該作為第二線治療,與他汀藥物聯合使用,當在最大耐受的他汀藥物劑量下未能達到治療目標時,或者在不能開處方他汀藥物的情況下使用。272,273
8.2.4 不良效應和相互作用
伊普利米布迅速被吸收並廣泛代謝為藥理活性的伊普利米布葡萄糖苷。伊普利米布的建議劑量為每天10毫克,可以在早上或晚上不論食物攝取而給予。年齡、性別或種族對伊普利米布的藥代動力學沒有臨床上顯著的影響,對於輕度肝功能受損或輕度至重度腎功能不全的患者,不需要劑量調整。使用伊普利米布作為單獨治療或與他汀藥物聯合使用時,極少見到危及生命的肝功能衰竭。將伊普利米布添加到他汀藥物治療中,似乎不會增加肌酸激酶(CK)水平升高的發生率,超出單獨使用他汀藥物治療時所觀察到的水平。261
8.3 膽酸螯合劑
8.3.1 作用機制
膽酸是在肝臟從膽固醇合成的,並釋放到腸道腔,但大多數膽酸通過主動吸收從末梢回腸回到肝臟。兩種較老的膽酸螯合劑,膽酸胺和膽固醇磷酸胺,都是膽酸結合交換樹脂。一些國家還提供合成藥物柯爾瑟韋(colesevelam)。由於膽酸螯合劑不被系統吸收或被消化酶改變,其有益的臨床效果是間接的。通過結合膽酸,這些藥物阻止藥物和膽固醇重新被吸收到血液中,因此從腸肝循環中去除了大部分膽酸。肝臟缺乏膽汁,因此從肝內膽固醇中合成更多膽酸,因此增加了肝內膽固醇的需求,並增加了LDLR的表達,從而降低了循環中的LDL。
8.3.2 對脂質的影響
在膽酸胺的最高日劑量24克,膽固醇磷酸胺的20克或柯爾瑟韋(colesevelam)的4.5克時,觀察到LDL-C降低了18–25%。未報告HDL-C的主要影響,而在一些易感患者中可能會增加TG。柯爾瑟韋還可以降低高血糖患者的葡萄糖水平。275
8.3.3 對心血管發病和死亡率的影響
在臨床試驗中,膽酸螯合劑在證明LDL-C降低對降低高膽固醇患者的心血管事件方面作出了巨大貢獻,其效益與LDL-C降低程度成正比。值得注意的是,這些研究是在現代許多治療選擇可用之前進行的。276–278
8.3.4 不良效應和相互作用
這些藥物通常會出現胃腸道(GI)不良效應(最常見的是腹脹,便秘,消化不良和噁心),即使在低劑量下也常常存在,這限制了它們的實際使用。這些不良效應可以通過低劑量開始治療並且在藥物攝入時攝取充足的液體來減輕。已報告脂溶性維生素的吸收減少。此外,這些藥物可能會增加某些患者的循環TG水平。
膽酸螯合劑與一些常見的處方藥物有重大的藥物相互作用,因此必須在其他藥物之前或之後4小時內給予。柯爾瑟韋(colesevelam)耐受性更好,與其他藥物的相互作用更少,可以與他汀藥物和其他幾種藥物一起使用。279
8.4 蛋白酶前體轉化酶亞型9抑制劑
8.4.1 作用機制
近年來,一類新的藥物,PCSK9抑制劑,已經上市,它針對參與控制LDLR的一種蛋白質(PCSK9)。280 血漿中這種蛋白質的濃度或功能升高會通過促使LDLR溶酶體降解,從而增加血漿中的LDL濃度,降低LDLR的表達,而PCSK9濃度或功能較低則與較低的血漿LDL-C水平相關。281 主要使用單克隆抗體(mAbs)開發了治療策略;其作用機制與降低PCSK9血漿水平有關,進而無法與LDLR結合。由於這種相互作用觸發了LDLR的細胞內降解,因此較低水平的循環PCSK9將導致細胞表面LDLR的表達增加,因此會降低循環中的LDL-C水平。281 目前,唯一獲批准的PCSK9抑制劑是兩種全人源mAb,alirocumab和evolocumab。他汀治療會增加循環PCSK9血清水平,282 因此,這些mAb的最佳效果已經在與他汀藥物結合使用時得到證明。
8.4.2 脂質影響
8.4.2.1 低密度脂蛋白膽固醇。
在臨床試驗中,alirocumab和evolocumab – 不論是單獨使用還是與他汀藥物和/或其他降脂治療結合使用 – 都已顯示出根據劑量平均降低60%的LDL-C水平,具體取決於劑量。效果似乎在很大程度上不依賴於任何背景治療。與高強度或耐受極限的他汀藥物結合使用時,alirocumab和evolocumab比安慰劑減少了46-73%的LDL-C,比ezetimibe多30%。在不能處方他汀藥物的患者中,與ezetimibe結合使用時,PCSK9抑制劑可以降低LDL-C。283 alirocumab和evolocumab都已被證明可以有效降低高心血管風險患者的LDL-C水平,包括那些患有糖尿病的患者。284
鑒於其作用機制,這些藥物能夠降低所有能夠在肝臟中表達LDLR的患者的LDL-C。因此,這種藥理學方法對大多數患者都有效,包括那些患有遺傳性高膽固醇血症的患者,盡管降低幅度較低,以及具有殘余LDLR表達的HoFH的患者。缺乏受體的HoFH對治療反應差。285
8.4.2.2 甘油三酯和高密度脂蛋白膽固醇。
這些高度有效的LDL降低劑也降低TG水平,並根據劑量方案增加HDL-C和ApoA-I的水平。在II期試驗中,evolocumab將TG水平降低了26%,將HDL-C和ApoA-I水平提高了9%和4%,類似的結果已報告給alirocumab。286,287 但必須在起始血漿TG水平較高的人群中確認TG的影響。
8.4.2.3 脂蛋白(a)。
與他汀藥物不同,使用mAb抑制PCSK9還可以降低Lp(a)的血漿水平。II期試驗的結果顯示,該治療導致Lp(a)減少約30-40%。288,289 儘管最近的研究試圖解開機制,但仍不清楚。但似乎不同於他汀藥物的作用機制,他汀藥物也增強了LDLR的功能,但在人類中不降低循環Lp(a)水平。這種效應對風險減少的相對貢獻尚待通過適當設計的研究來解決。
8.4.3 對心血管發病率和死亡率的影響
來自III期試驗的早期初步數據表明,與LDL-C降低相一致,心血管事件有所減少。286,290,291
最近,完成了兩項重大研究:Further Cardiovascular Outcomes Research with PCSK9 Inhibition in Subjects with Elevated Risk(FOURIER)和Evaluation of Cardiovascular Outcomes After an Acute Coronary Syndrome During Treatment With Alirocumab(ODYSSEY Outcomes)試驗。119,120 這些試驗的設計在二級預防和背景治療方面相似;然而,入組人群分別具有穩定的冠心病,周邊動脈疾病(PAD)或中風;或最近(中位2.6個月)發生急性冠狀動脈綜合症(ACS)。相對效益範圍從主要結局風險的15-20%降低。這兩個研究的隨訪期相對較短,而他汀試驗的證據表明,LDL降低的臨床效益可能僅在約1年後才會出現,因此這些試驗可能低估了長期治療的潛在影響。120,290
在FOURIER試驗中,119接受他汀治療的有動脈粥樣疾病的27,564名患者,LDL-C水平在基線時為1.8 mmol/L(70 mg/dL)或更高,被隨機分為接受evolocumab或安慰劑。分配到evolocumab的患者,48周時,中位數LDL-C從基線的2.38 mmol/L(92 mg/dL)降至平均0.78 mmol/L(30 mg/dL)。在隨訪時間的中位數為2.2年後,evolocumab治療顯著降低了主要結局(心血管死亡、心肌梗死、中風、不穩定性心絞痛住院治療或冠狀動脈重建的綜合結局)的風險15%(危險比0.85,95% CI 0.79–0.92)。時間效益分析還顯示,第一年的效益較低,而後續年份的效益較高,與CTT荟合分析中觀察到的他汀藥物的效果一致。268在FOURIER試驗中,分配到evolocumab的患者未降低心血管死亡風險(危險比1.05,95% CI 0.88–1.25)或全因死亡風險。
ODYSSEY Outcomes試驗隨機分配了18,924名急性心肌梗死或不穩定心絞痛住院治療患者,接受他汀治療,並且LDL-C≥1.8 mmol/L(≥70 mg/dL),非HDL膽固醇≥2.6 mmol/L(≥100 mg/dL)或ApoB≥80 mg/dL,接受alirocumab或相符的安慰劑注射。分配到alirocumab的患者,12個月時,平均基線LDL-C從2.38 mmol/L(92 mg/dL)降至1.24 mmol/L(48 mg/dL)。在中位隨訪時間為2.8年後,主要結局(冠心病死亡、非致命性心肌梗死、缺血性中風或需要住院治療的不穩定心絞痛的綜合結局)相對減少15%(危險比0.85,95% CI 0.78–0.93)。儘管ODYSSEY試驗中所有原因的死亡率有顯著降低,但這只是一個探索性結局,並不受對心血管死亡的明顯影響的支持。
8.4.3 對心血管發病率和死亡率的影響
來自III期試驗的早期初步數據表明,與LDL-C降低相一致,心血管事件有所減少。286,290,291
最近,完成了兩項重大研究:Further Cardiovascular Outcomes Research with PCSK9 Inhibition in Subjects with Elevated Risk(FOURIER)和Evaluation of Cardiovascular Outcomes After an Acute Coronary Syndrome During Treatment With Alirocumab(ODYSSEY Outcomes)試驗。119,120 這些試驗的設計在二級預防和背景治療方面相似;然而,入組人群分別具有穩定的冠心病,周邊動脈疾病(PAD)或中風;或最近(中位2.6個月)發生急性冠狀動脈綜合症(ACS)。相對效益範圍從主要結局風險的15-20%降低。這兩個研究的隨訪期相對較短,而他汀試驗的證據表明,LDL降低的臨床效益可能僅在約1年後才會出現,因此這些試驗可能低估了長期治療的潛在影響。120,290
在FOURIER試驗中,119接受他汀治療的有動脈粥樣疾病的27,564名患者,LDL-C水平在基線時為1.8 mmol/L(70 mg/dL)或更高,被隨機分為接受evolocumab或安慰劑。分配到evolocumab的患者,48周時,中位數LDL-C從基線的2.38 mmol/L(92 mg/dL)降至平均0.78 mmol/L(30 mg/dL)。在隨訪時間的中位數為2.2年後,evolocumab治療顯著降低了主要結局(心血管死亡、心肌梗死、中風、不穩定性心絞痛住院治療或冠狀動脈重建的綜合結局)的風險15%(危險比0.85,95% CI 0.79–0.92)。時間效益分析還顯示,第一年的效益較低,而後續年份的效益較高,與CTT荟合分析中觀察到的他汀藥物的效果一致。268在FOURIER試驗中,分配到evolocumab的患者未降低心血管死亡風險(危險比1.05,95% CI 0.88–1.25)或全因死亡風險。
ODYSSEY Outcomes試驗隨機分配了18,924名急性心肌梗死或不穩定心絞痛住院治療患者,接受他汀治療,並且LDL-C≥1.8 mmol/L(≥70 mg/dL),非HDL膽固醇≥2.6 mmol/L(≥100 mg/dL)或ApoB≥80 mg/dL,接受alirocumab或相符的安慰劑注射。分配到alirocumab的患者,12個月時,平均基線LDL-C從2.38 mmol/L(92 mg/dL)降至1.24 mmol/L(48 mg/dL)。在中位隨訪時間為2.8年後,主要結局(冠心病死亡、非致命性心肌梗死、缺血性中風或需要住院治療的不穩定心絞痛的綜合結局)相對減少15%(危險比0.85,95% CI 0.78–0.93)。儘管ODYSSEY試驗中所有原因的死亡率有顯著降低,但這只是一個探索性結局,並不受對心血管死亡的明顯影響的支持。
8.4.4 不良反應和相互作用
抗PCSK9單克隆抗體是每隔一周或每月一次皮下注射,劑量取決於所使用的藥物。由於這些藥物不會干擾藥物的藥代動力學或藥效動力學,因此不會與口服藥物發生相互作用。最常報告的副作用之一是注射部位的瘙癢和類似流感的症狀。292在一些研究中,患者報告的神經認知效應增加。293然而,特別設計用於檢測神經認知功能變化的EBBINGHAUS試驗231令人放心,FOURIER和ODYSSEY試驗的安全報告也是如此。Mendelian隨機化研究還表明,PCSK9抑制可能會增加與LDL-C相關的DM風險,就像他汀藥物一樣。294到目前為止,從RCT中並未出現信號。295–297儘管需要大規模的長期PCSK9抑制劑試驗來排除這些和PCSK9抑制劑的其他潛在副作用,298IMPROVE-IT研究的7年數據顯示,長期低LDL-C濃度與任何明顯的不良反應無關。299
長期抗體治療的潛在問題是自體抗體的出現。Evolocumab和alirocumab是全人源抗體,因此在理論上不太可能誘導自體抗體。到目前為止,只報告了非常少數的抗藥物抗體病例,並且未觀察到LDL-C降低的減少,但需要監測長期使用。事實上,第三個PCSK9抑制劑bococizumab的開發計劃被停止,原因是抗中和抗體的增加,導致隨著時間的推移LDL-C降低效應減弱,以及注射部位反應的發生率增加。300然而,儘管PCSK9抑制劑是非常有效的藥物,可以在他汀和/或依捷脂滴定治療的基礎上降低LDL-C和CV事件,但考慮到治療的成本以及長期安全性的有限數據,這些藥物可能只在極高ASCVD風險的患者中被認為具有成本效益,並且在一些資源有限的國家可能無法使用。
8.5 Lomitapide
微粒體三酸甘油酯轉移蛋白(MTP)將三酸甘油酯和磷脂從內質網轉移到載脂蛋白B,這是肝臟形成VLDL的必要步驟。因此,MTP抑制劑可以阻止肝臟中VLDL的形成和腸道中乳糜微粒的形成。
Lomitapide是一種針對HeFH的MTP抑制劑,經口每天一次給藥。在一項開放標籤的單臂滴定研究中,評估了lomitapide作為輔助治療的作用,該療法與他汀藥物,有無血漿置換和低脂飲食相結合,301 LDL-C在26周時從基線降低了50%,在56周時降低了44%。Lomitapide還被顯示可以減少HoFH患者的血漿置換頻率。應注意,尚未確定該藥對心血管結果的影響。
由於其作用機制,lomitapide已被證明與氨基轉移酶水平升高有關,這很可能反映了肝臟中脂肪的增加,以及消化道耐受性差。301消化道副作用是臨床試驗中防止進一步增加lomitapide劑量的最常見原因。然而,已經注意到,消化道副作用的頻率和強度通常會隨著時間的推移而減少。因此,處方lomitapide需要仔細的患者教育和治療期間的肝功能監測。
8.6 Mipomersen
Mipomersen是一種反義寡核苷酸,能夠結合ApoB-100的信使RNA(mRNA),從而觸發mRNA分子的選擇性降解。皮下注射後,這種寡核苷酸主要運送到肝臟,並結合到特定的mRNA,阻止ApoB蛋白的翻譯,從而減少具有致動作用的脂質和載脂蛋白的產生,包括LDL和Lp(a)。303 mipomersen作為降脂藥物和飲食的輔助劑,用於降低HoFH患者的LDL-C。 mipomersen目前已獲得美國食品和藥物管理局(FDA)批准,但未獲得歐洲藥物管理局(EMA)批准。
在接受mipomersen治療的患者中,注射部位的反應是最常見的不良反應。304然而,關於mipomersen安全性的主要擔憂與肝毒性有關。 mipomersen可能導致脂肪肝的發展。接受治療的患者在基線的基礎上顯示出比隨機分配至安慰劑的患者更高的肝臟脂肪增加。303目前正在評估長期mipomersen治療在重度HeFH患者和他汀’不耐受’患者中的療效和安全性。
8.7 鈣拮抗劑
8.7.1 作用機制
鈣拮抗劑是過氧化物酶體增生子激活受體-α(PPAR-α)的激動劑,通過調節轉錄因子來調節脂質和脂蛋白代謝的各個步驟,以及其他因素。因此,鈣拮抗劑對降低禁食三酸甘油酯(TG)水平以及進食後的三酸甘油酯和富含三酸甘油酯(TRL)殘餘粒子具有良好的療效。
8.7.2 對脂質的影響
不同種類的鈣拮抗劑對脂質譜的臨床影響各有不同,但估計可以降低50%的TG水平,降低≤20%的LDL-C水平(但在高TG水平下可能會觀察到小的LDL-C增加),並使HDL-C水平增加≤20%。效果的大小高度依賴於基線脂質水平。305在沒有升高TG水平的T2DM患者中,報導的鈣拮抗劑既提高HDL水平又降低TG水平的效果明顯較小(約為5%和20%,分別)。306,307
8.7.3 對心血管疾病發病率和死亡率的影響
纖維體對脂質譜的臨床效果主要由六項隨機對照試驗(RCT)說明:赫爾辛基心臟研究(HHS)、美國退伍軍人事務部高密度脂蛋白膽固醇干預試驗(VA-HIT)、貝沙非布雷特預防心肌梗塞試驗(BIP)、下肢動脈疾病事件減少試驗(LEADER)、糖尿病患者芬費布雷特干預和事件減少試驗(FIELD)以及糖尿病患者心血管風險控制行動試驗(ACCORD); 在後一項試驗中,芬費布雷特被添加到他汀治療中。306–311在纖維體的心血管結局試驗中,風險降低似乎與非HDL-C降低的程度成比例。50
雖然赫爾辛基心臟研究報告稱用吉非贝酯(gemfibrozil)能夠顯著減少心血管疾病結局,但芬費布雷特參與的FIELD和ACCORD研究均未顯示總心血管疾病結果的減少。LEADER試驗包括下肢動脈疾病的男性參與者,未能顯示貝沙非布能夠導致臨床上重要的心血管疾病合併結局的減少。儘管有報導指出非致命性心肌梗塞率減少,但這通常是由於事後分析的結果。該效果在TG升高/低HDL-C水平的人中最為明顯。然而,有關其他結局參數的數據仍然不確定。只有一項研究ACCORD對比了纖維體作為他汀的附加治療的效果。最近的兩個荟萃分析並未報告總體效益。312,313其他荟萃分析的结果表明,在接受纖維體治療的高TG和低HDL-C患者中,可降低主要心血管事件的發生率,但不能降低心血管疾病或總死亡率。314–316因此,纖維體對心血管疾病結局的總體療效遠不及他汀類藥物。最近,一種新型選擇性PPAR-α調節劑(pemafibrate)已被報導具有顯著的降低TRL的療效。317該研究,即“Pemafibrate to Reduce Cardiovascular OutcoMes by Reducing Triglycerides IN PatiENts With DiabeTes(PROMINENT)”,是一項正在進行中的心血管疾病結局試驗,旨在評估pemafibrate對一萬名高危糖尿病患者的療效,這些患者具有高TG和低HDL-C水平。318總之,纖維體的潛在心血管益處需要進一步確認。
8.7.4 不良反應和相互作用
纖維體通常耐受性良好,不良反應輕微,報導的胃腸道不適在<5%的患者中有報告,皮膚疹在2%的患者中有報告。319總的來說,肌無力、肝酶升高和膽固醇結石代表與纖維體治療相關的最知名的不良反應。319報導指出,與他汀藥物相比,單用纖維體(主要是吉非贝酯)的肌無力風險增加了5.5倍,並且在結合使用不同纖維體和他汀的不同途徑的情況下,風險也有所不同。這可以解釋不同纖維體的代謝和他汀的葡萄糖酸鈉化途徑之間的藥物相互作用。吉非贝酯通過葡萄糖酸鈉化途徑抑制他汀的代謝,從而使他汀的血漿濃度大幅增加。320由於芬費布雷特的代謝途徑與吉非贝酯不同,因此這種聯合治療的肌無力風險要小得多。319
作為一個類別,纖維體已報導在短期和長期研究中均可提高血清肌酸激酶和同型半胱氨酸水平。纖維體治療引起的血清肌酸激酶增加似乎在停藥後可以完全逆轉。荟萃分析的數據表明,計算的腎小球濾過率(GFR)的降低不反映腎功能的不良影響。315纖維體與胰臟炎的風險稍微增加。321由纖維體引起的同型半胱氨酸水平升高被認為與心血管疾病風險相對中性。然而,纖維體引起的同型半胱氨酸增加可能會減弱HDL-C和ApoA1水平的升高,這種效應可能有助於解釋芬費布雷特在心血管結局參數中的效益小於估計值的原因。322
8.8 n-3脂肪酸
8.8.1 作用機制
n-3(或ω-3)脂肪酸[二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)]可以以藥理學劑量用於降低三酸甘油脂(TG)。n-3脂肪酸(每天2-4克)影響血清脂質和脂蛋白,特別是VLDL濃度。其基本機制尚不清楚,儘管它可能至少部分地與其與PPAR的相互作用以及ApoB的分泌減少有關。
8.8.2 對脂質的影響
n-3脂肪酸可以降低TG,但對其他脂蛋白的影響微不足道。需要更詳細的臨床結果數據來證明處方n-3脂肪酸的廣泛使用。323降低TG所需的EPA和DHA的總劑量建議在每天2-4克之間變化。最近的三項研究中,使用EPA的高TG患者報告了劑量依賴性的顯著降低血清TG水平,最高可達45%。324–326荟萃分析也報告了ω-3脂肪酸降低血清TG的有效性。157最近,“降低非常高三酸甘油脂(EVOLVE II)”試驗證實了ω-3脂肪酸降低血清TG的有效性。327
8.8.3 對心血管疾病發病率和死亡率的影響
Cochrane荟萃分析包括79個試驗,共有112,059名參與者,報告了omega-3脂肪酸對總死亡率(相對風險0.98,95% CI 0.90–1.03)或心血管事件(相對風險0.99,95% CI 0.94–1.04)的整體影響不大,只有提示omega-3脂肪酸降低冠心病事件(相對風險0.93,95% CI 0.88–0.97)的趨勢。328最近,“糖尿病心血管事件研究(ASCEND)”試驗329將15,480名糖尿病患者隨機分為n-3脂肪酸組和安慰劑組,這些患者沒有動脈粥樣心血管疾病,經過平均7.4年的隨訪後,結果顯示在嚴重血管事件風險上沒有明顯差異(相對風險1.00,95% CI 0.91–1.09)。
數據仍然不確定,omega-3脂肪酸的臨床療效似乎與非脂質效應有關。330,331此外,使用omega-3脂肪酸的研究通常使用的劑量(每天1克)對血漿脂質的影響不大,因為降低血漿TG所需的劑量大於2克/天。降低冠心病事件風險的“REDUCE-IT”試驗195旨在評估omega-3油(EPA)對TG升高的人群的ASCVD結果的潛在益處;該試驗招募了約8000名正在接受他汀治療的患者,其LDL-C水平在1.0-2.6mmol/L(41-100mg/dL)之間,並且具有多種CV風險因素,包括持續升高的TG水平(1.7-5.6mmol/L或150-499mg/dL),以及已確診的ASCVD或DM,以及至少一個其他CV風險因素。與安慰劑(礦物油)相比,使用高劑量(每日2克b.i.d.)的EPA,結果顯示主要不良CV事件(MACE)的相對風險減少了約25%(P <0.001)。另一個隨機的安慰劑對照試驗,“STRENGTH”332旨在確定在接受他汀治療的患者中,降低TRL和殘留物是否會提供額外的ASCVD風險降低。正在進行中。最近,一項研究的數據將攝入高劑量omega-3多不飽和脂肪酸與前列腺癌的風險相關聯。334
8.8.4 安全性和相互作用
給予n-3脂肪酸似乎是安全的,沒有明顯的臨床相互作用。最常見的副作用是胃腸不適。抗血栓作用可能會增加出血的傾向,特別是在與阿司匹林/克洛匹多一起使用時。最近,一項研究的數據將攝入高劑量omega-3多不飽和脂肪酸與前列腺癌的風險相關聯。334
8.9 菸鹼酸
菸鹼酸在肝臟和脂肪組織中都有關鍵作用位點。 在肝臟中,菸鹼酸抑制二醯基甘油醯基轉移酶-2,導致VLDL顆粒的分泌減少,這也反映在IDL和LDL顆粒的血漿濃度降低。 335菸鹼酸主要透過刺激肝臟中的ApoA1產生來提高HDL-C和ApoA1水平。 335兩項使用菸鹼酸的大型隨機試驗—一項使用緩釋菸鹼酸66,另一項使用菸鹼酸和拉羅匹普蘭特67—均未顯示出有益效果,並出現了嚴重不良反應的 增加。 目前,歐洲尚未批准任何含菸鹼酸的藥物。
8.10 膽固醇酯轉移蛋白抑制劑
迄今為止,導致HDL-C水平顯著升高的藥理學方法是透過小分子抑制劑直接抑制CETP,這可能會導致HDL-C水平根據劑量依賴性增加≥100%。 托西特普曾在「血脂水平管理調查以了解其對動脈粥樣硬化事件的影響(ILLUMINATE)」試驗中研究過,該試驗因增加死亡率而被提前停止。 336 達西特普使HDL-C水平升高30-40%,對LDL-C沒有明顯影響,從而提供了關於純HDL-C升高的具體見解。 然而,在dal-OUTCOMES試驗中,達西特普並未顯示出在ACS患者中獲得任何益處。 依瓦西特普提高HDL-C水準130%,降低LDL-C水準37%,曾在ACCELERATE試驗中進行研究,但因無效而終止。 最近,在REVEAL試驗中研究了阿納塞特普,該藥物提高了HDL-C和ApoA-I水平(分別提高了104%和36%),並降低了LDL-C和ApoB水平(分別降低了 17%和18%)。 阿納塞特普在4.1年的中位數追蹤期內將主要冠心病事件降低了9%。 64 相對風險降低的幅度似乎與LDL-C或非HDL-C水準降低的幅度一致。 337 該藥物尚未提交申請獲得監管批准。
8.11 未來展望
8.11.1 降低低密度脂蛋白膽固醇的新方法
一種針對PCSK9的替代方法是RNA幹擾。 在一項I期和一項II期試驗中,小幹擾RNA(siRNA)分子inclisiran-它抑制PCSK9的合成-將LDL-C降低了高達50%,降低量與劑量呈正相關。 PCSK9和LDL-C水平的降低保持了≤6個月。 338,339 沒有觀察到特定的嚴重不良事件。 HPS4/TIMI65/ORION4試驗計畫平均持續5年,目前正在比較15,000名先前患有心肌梗塞或中風的患者中的inclisiran與安慰劑。
苯匹多酸是一種新穎的口服小分子,它透過抑制ATP檸檬酸裂解酶的作用來抑制膽固醇合成,這是3-羥基-3-甲基戊二酰輔酶A還原酶上游的胞漿酶 。 340 到目前為止,它已經在糖尿病患者、有或沒有他汀類藥物’不耐受’的患者中進行了測試。 在單藥療法中,苯匹多酸將LDL-C水平降低了約30%,與依智貝聯合使用後將其降低了約50%。 苯匹多酸目前正在進行III期試驗,一些試驗已經完成。 341,342
8.11.2 降低三酸甘油酯富含脂蛋白及其殘餘的新方法
8.11.3 增加高密度脂蛋白膽固醇的新方法
儘管遺傳研究表明低HDL-C水平不是ASCVD的原因,從而對未來提高HDL-C水平的治療選擇產生懷疑,但在尋找能夠提高HDL-C和ApoA1水平並同時對動脈粥樣硬化和心血管事件 產生益處的有效藥物方面,取得了重大進展。 一方面,人們關注ApoA1模擬勝肽和具有潛在體內HDL粒子重塑和增強心臟保護作用的重組HDL的研究。 350 另一方面,一些增強富含TG脂蛋白降解的藥物,如ApoC-III的抗義核糖核酸,可導致TG的同時降低(~70%)和HDL-C的顯著升高(~40%) ,正在研發中。 351 但重要的是,目前我們尚不了解提高HDL/ApoA-I水平的方式與HDL粒子可能的抗動脈粥狀硬化功能之間的關係。
8.11.4 降低脂蛋白(a)水平的新方法
另一個正在研究的方法是選擇性減少Lp(a)(脂蛋白(a))濃度。RNA基礎的療法目前正在臨床環境中進行評估。在正常Lp(a)值和高Lp(a)濃度的患者中進行的反義寡核苷酸研究結果顯示了超過90%的降低。352 這些方法目前正在第二期至第三期研究中進行評估,並計劃進行一項成果試驗,以研究Lp(a)減少是否能轉化為風險降低。
8.12 控制血漿膽固醇的策略
儘管許多患者通過單一治療就能達到LDL-C(低密度脂蛋白膽固醇)的目標,但仍有相當比例的高風險患者或LDL-C水平非常高的患者需要額外治療。在這種情況下,合併治療是合理的。對於那些處於非常高風險且儘管使用最大耐受劑量的他汀類藥物治療仍持續高風險的患者,建議與依折麥布(ezetimibe)合用,如果仍未達到目標,則建議加用PCSK9抑制劑(參見圖4和降低低密度脂蛋白膽固醇的藥物治療建議)。值得注意的是,直接將PCSK9抑制劑加入他汀類藥物也是可行的120,290(見圖4)。
圖3降低低密度脂蛋白膽固醇治療的預期臨床益處。對於任何人來說,降低低密度脂蛋白膽固醇治療的預期臨床益處是可以估計的;它取決於治療的強度、基線低密度脂蛋白膽固醇水平、預期達到的低密度脂蛋白膽固醇絕對降低量,以及基線動脈粥樣硬化心血管疾病的估計風險。治療的強度應根據個人動脈粥樣硬化心血管疾病的估計風險來選擇,以達到建議的低密度脂蛋白膽固醇比例降低。將低密度脂蛋白膽固醇的比例降低乘以個人的基線低密度脂蛋白膽固醇水平,可以估計出使用該治療可能達到的預期低密度脂蛋白膽固醇絕對降低量。由於每降低1.0 mmol/L的低密度脂蛋白膽固醇與降低20%的心血管事件風險相關,較大的低密度脂蛋白膽固醇絕對降低量將導致較大的風險比例降低。將達到的低密
度脂蛋白膽固醇絕對降低量所預期的風險比例降低乘以個人動脈粥樣硬化心血管疾病的基線估計風險,可確定該個人的預期絕對風險降低。LDL-C = 低密度脂蛋白膽固醇;PCSK9 = 前蛋白轉換酶亞基丝氨酸/凯克生型9。
圖4(A) 降低低密度脂蛋白膽固醇藥物治療的治療演算法。 (B) 在不同總心血管疾病風險分類下的低密度脂蛋白膽固醇治療目標。ASCVD = 動脈粥樣硬化性心血管疾病;BP = 血壓;CKD = 慢性腎臟疾病;CV = 心血管;DM = 糖尿病;eGFR = 估算的腎小球過濾率;FH = 家族性高膽固醇血症;LDL-C = 低密度脂蛋白膽固醇;PCSK9 = 前蛋白轉化酶類型 9;SCORE = 系統性冠心疾病風險估計;T1DM = 1 型糖尿病;T2DM = 2 型糖尿病;TC = 總膽固醇。
如圖 3 所示,降低任何人的低密度脂蛋白膽固醇(LDL-C)水平的治療預期臨床益處可以估算;它取決於治療的強度、基線LDL-C水平和基線ASCVD風險的估算。這個簡單的演算法可用於幫助臨床醫生選擇適當的治療,並量化LDL-C降低治療的預期益處,以幫助與患者進行討論。為了方便參考,附表 3 提供了在特定基線LDL-C水平下,可以通過不同治療方法實現的絕對LDL-C降低的摘要。
8.13 控制血漿三酸甘油酯的策略
儘管在禁食時三酸甘油酯(TGs)>1.7 mmol/L(>150 mg/dL)時心血管疾病(CVD)風險增加,但僅當TGs>2.3 mmol/L(>200 mg/dL)且無法通過生活方式措施降低TGs時,才可能考慮使用降低TG水平的藥物。目前可用的藥物干預包括他汀類、纖維酸類、PCSK9 抑制劑和 n-3 不飽和脂肪酸。一項包括接受各種降低血清TG的藥物治療的人的 10 項試驗的荟萃分析報告顯示,心血管結果減少了 12%。最近的 REDUCE-IT 試驗194表明,在已接受他汀治療且心血管風險高的患者中,禁食 TG 水平在 135-499 mg/dL(1.52-1.63 mmol/L)之間的高劑量 icosapent ethyl,一種高度純化和穩定的 EPA(2 g),每日兩次服用,可以在4.9年的中位隨訪期內將缺血事件的風險,包括心血管死亡,減少約四分之一。此外,VITAL 試驗顯示,每日 1 g 的 n-3 脂肪酸對於中年健康男女的心血管或癌症事件的初級預防並不有效,隨訪 5 年。以下是高三酸甘油酯(HTG)治療的建議。
9 處理不同臨床情境下的脂質異常
9.1 家族性脂質異常
血漿脂質水平在很大程度上受基因因素的影響。在其更極端的形式中,這表現為家族性脂質異常。已經確定了一些單基因脂質異常疾病;在這些中,家族性高膽固醇血症(FH)最為常見,並且與心血管疾病(表11)密切相關。一般來說,在患有脂質異常的患者中,遺傳模式通常不暗示存在一個主要的單一基因(單基因)疾病導致異常;相反,它源於繼承了影響脂蛋白代謝的多個基因變體,這些基因變體單獨可能影響相對較小,但與其他或其他基因結合時對總膽固醇(TC)、三酸甘油酯(TGs)或高密度脂蛋白膽固醇(HDL-C)具有更大的影響。遺傳模式是多基因的。通常發現高LDL-C、高TG或低HDL-C水平影響到幾位家庭成員。
表11 脂蛋白代謝的遺傳性疾病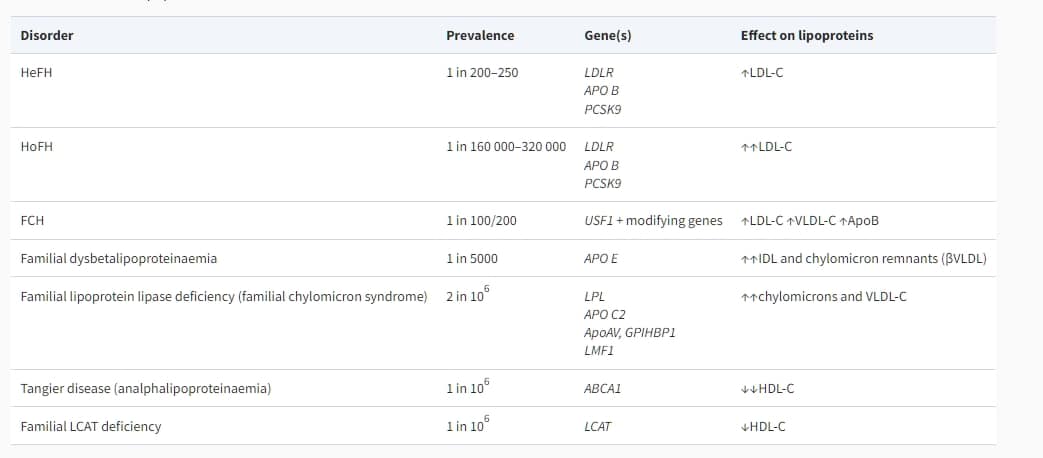
9.1.1 家族性混合型高脂血症
家族性混合型高脂血症(FCH)是一種高度普遍的混合型脂質異常(1:100–200),其特徵是低密度脂蛋白膽固醇(LDL-C)、三酸甘油酯(TGs)或兩者水平升高,並且是早發性冠心病的重要原因。FCH是一種複雜的疾病,表現型是由多個易感基因和環境的相互作用所決定的。它在某種程度上與2型糖尿病和代謝綜合症的脂質異常表現型有很大重疊。即使在家庭中,根據脂質值(TGs、LDL-C、HDL-C 和 ApoB),表現型也表現出高度的人際和個體變異性。FCH沒有單基因成分,並且與單一基因原因無關,但表現型是高LDL-C和/或高TGs。因此,在臨床實踐中,通常會錯過診斷;結合ApoB >120 mg/dL 和TGs >1.5 mmol/L (>133 mg/dL)以及早發性心血管疾病家族史的人可能最可能患有FCH。混合型脂質異常的概念在評估心血管風險方面在臨床上也具有價值。它強調在決定治療脂質異常的嚴格程度時考慮家族史的重要性,並且當高三酸甘油酯(HTG)也存在時,升高的LDL-C水平預示著更高的風險。他汀類藥物治療在具有HTG的人群中和在沒有HTG的人群中相對程度上降低了心血管風險。由於HTG患者的絕對風險通常更高,因此他們可能會因LDL降低治療而受益匪淺。
9.1.2 家族性高膽固醇血症
9.1.2.1 非同型家族性高膽固醇血症。
家族性高膽固醇血症(FH)是一種常見的共显性單基因脂質異常,由於終身高水平的低密度脂蛋白膽固醇(LDL-C)而導致早發性心血管疾病。如果不治療,患有非同型FH(HeFH)的男性和女性通常在55歲和60歲之前分別發展出早期冠心病。據估計,患有明確或可能的HeFH的個體冠心病風險至少增加了10倍。然而,早期診斷和適當治療可以顯著降低冠心病風險。
在全球范圍內,估計HeFH在人口中的患病率為1/200–250,對應著全球範圍內約1,400萬至3,400萬例的病例。然而,只有其中的一小部分病例被確認並得到適當治療。
FH是由LDLR或apoB基因中的功能缺失突變,或PCSK9基因中的功能增強突變引起的單基因疾病;約95%的FH病例是由LDLR基因的突變引起的。已經在LDLR中識別了引起FH的超過1000種不同突變。這些不同的突變引起了功能減退或完全失效,後者與更嚴重的高膽固醇血症和心血管疾病相關。
通常,FH的診斷基於臨床表現。荷蘭脂質診所網絡的常用標準如表12所示。其他標準包括Simon Broome登記或WHO標準。
表12 荷蘭脂質診所網絡家族性高膽固醇血症的診斷標準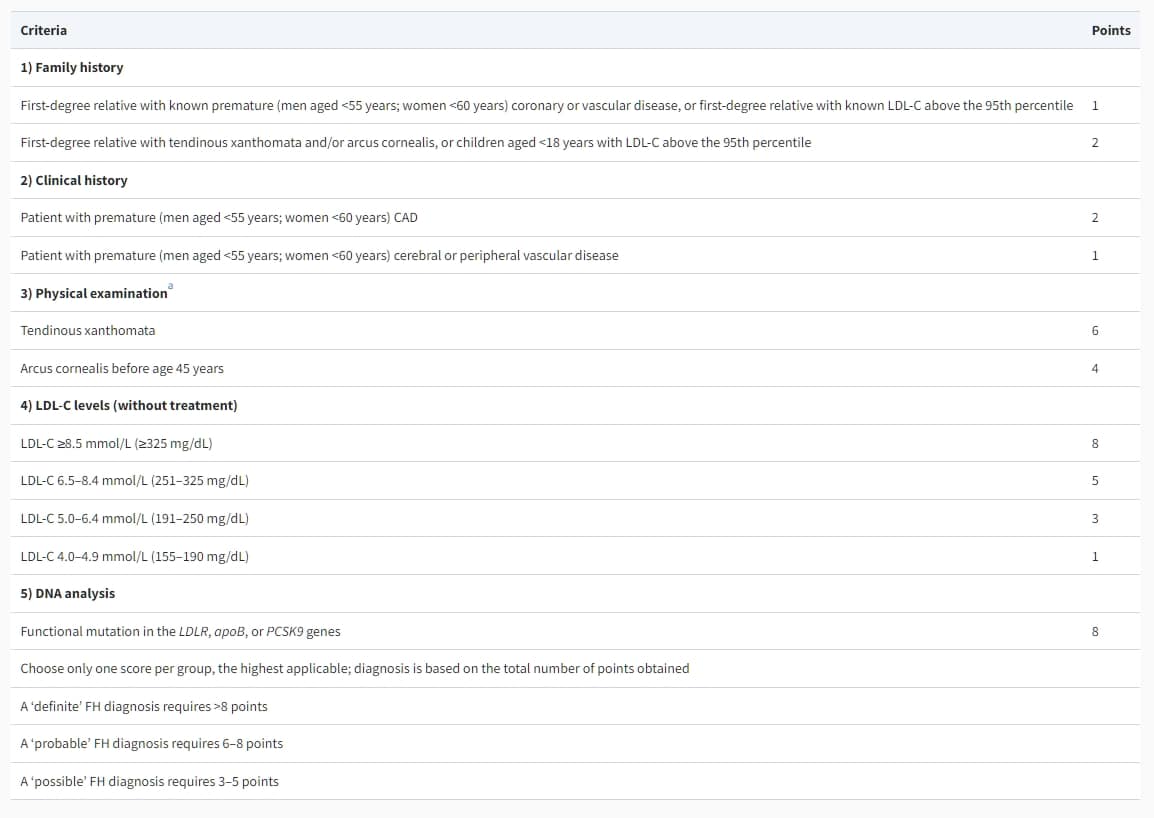
診斷可以通過顯示致病基因中的致病突變來進行確認。然而,在大多數研究中,具有明確或可能的非同型家族性高膽固醇血症(HeFH)的患者中,可檢測到突變的頻率在60%至80%之間。這表明,相當一部分FH患者可能患有多基因性疾病的原因,或者尚未確定的其他基因也可能參與其中。
基因檢測和連鎖篩查。應根據以下標準確定原發病例(索引病例):
成人或成年家庭成員未經治療的TC ≥8 mmol/L(≥310 mg/dL)(或按國家/地區的年齡和性別百分位數>95th)
患者或家庭成員存在早發性冠心病
患者或家庭成員存在腱黃色瘤
家庭成員有突然早發性心臟死亡
對已知索引病例的家庭成員進行連鎖篩查,可以有效地識別新病例。最好由脂質診所執行連鎖篩查。在大多數家庭中,可以通過測定TC或LDL-C來識別病例;然而,當已知致病突變時,建議進行基因檢測。
在確診後應盡快開始降低膽固醇的治療。為了改善風險評估,建議使用影像技術來檢測無症狀的動脈粥樣硬化。累積性膽固醇負擔的概念說明了早期治療的重要性(有關兒童,請參見下文)。治療應該始於高強度他汀治療,大多數情況下與依非賓結合使用。對於因既往有ASCVD或其他主要風險因素而處於非常高ASCVD風險的FH患者,LDL-C目標是從基線減少≥50%,並且LDL-C <1.4 mmol/L (<55 mg/dL)。在沒有ASCVD或其他主要風險因素的情況下,FH患者被分為高風險,LDL-C目標是從基線減少≥50%,並且LDL-C <1.8 mmol/L (<70 mg/dL)。
PCSK9抑制劑可在他汀治療的基礎上將LDL-C水平降低多達60%。兩個隨機對照試驗報告了在沒有FH的ASCVD患者中對臨床結局的有益影響。如果在最大耐受的他汀加依非賓治療下未達到治療目標,則建議在非常高風險的FH患者中使用PCSK9抑制劑。如果FH患者無法耐受他汀,也建議使用PCSK9抑制劑。
9.1.2.2 同質性家族性高膽固醇血症
同質性家族性高膽固醇血症(HoFH)是一種罕見且危及生命的疾病。其臨床表現特徵包括大面積黃色瘤、明顯的早發性和漸進性心血管疾病,以及TC >13 mmol/L (>500 mg/dL)。大多數患者在20歲之前發展冠心病和主動脈瓣狹窄,並在30歲之前去世。HoFH的頻率估計為1/160,000–1/320,000。及早識別這些兒童並及時轉介至專科診所至關重要。患者應接受強化的LDL降低藥物治療,並在有條件的情況下進行脂蛋白吸附療法。此治療(每1–2周一次)可以將血漿中的LDL-C水平降低55–70%。隨著脂質水平、症狀和其他與疾病相關的參數的變化,可以調整程序的頻率。必須維持最大容忍的藥物治療。關於HoFH的更詳細討論,請參見EAS共識聲明。
9.1.2.3 兒童中的家族性高膽固醇血症
FH在兒童中的診斷基於表型標準,包括升高的LDL-C以及家族史中有升高的LDL-C、早發性冠心病和/或陽性的基因檢測。在兒童期間,使用LDL-C來區分FH和非FH是最理想的。對於家族中有高膽固醇或早發性冠心病家族史的兒童,被接受的截止值為≥4.0 mmol/L(≥160 mg/dL)。如果一個父母有已知的基因缺陷,孩子的診斷水平為≥3.5 mmol/L(≥130 mg/dL)。如果可能的話,建議對兒童進行基因檢測。
儘管在兒童中尚未進行安慰劑對照試驗,但觀察性研究表明,早期治療可以減少LDL-C負擔,改善內皮功能,大大減輕動脈粥樣硬化的發展,並改善冠狀動脈結局。兒童的治療包括健康的生活方式和他汀治療。應在早年採用心臟健康飲食,並在6–10歲時考慮使用他汀治療。他汀治療應從低劑量開始,然後逐漸增加劑量以達到目標。>10歲的兒童的目標是LDL-C <3.5 mmol/L (<135 mg/dL),而在較年幼的年齡段,則是LDL-C的≥50%降低。
9.1.3 家族性異常乳脂蛋白血症
家族性異常乳脂蛋白血症(即III型高脂蛋白血症;殘餘清除障礙疾病)是一種罕見的疾病,通常以變異穿透不一致的常染色體隱性遺傳方式傳播。家族性異常乳脂蛋白血症在治療之前會使TC和TG都升高,通常都在7–10 mmol/L的範圍內。在嚴重病例中,患者會在肘部和膝蓋上發展出顆粒性黃色瘤,以及在手和手腕的皮膚皺褶處的掌狀黃色瘤。冠心病的風險非常高,而大腿和脛骨動脈的加速粥樣硬化也很常見。這種綜合徵通常不會在年輕年齡或女性停經前表現出來。大多數情況下,患者都是ApoE的E2亞型的同質子。ApoE對乳糜殘餘和IDL的肝清除很重要。ApoE2不如E3和E4亞型易於結合到肝臟受體上。然而,如果沒有與高三酸甘油酯(HTG)、糖尿病、肥胖或甲狀腺功能減退等其他致病性疾病的巧合致病原因,ApoE2的同質性通常不會引起家族性異常乳脂蛋白血症。
在脂質異常患者中檢測到ApoE2的同質性是診斷的,而ApoE異構體的分析現在在大多數臨床實驗室中都是可用的。可以根據膽固醇、三酸甘油酯和ApoB的血漿水平來可靠地預測家族性異常乳脂蛋白血症的特徵性膽固醇殘餘物。如果懷疑確認,則可以進行ApoE基因分型。對於年紀較大且患有與家族性異常乳脂蛋白血症相似的黃色瘤的患者,如果證明不是ApoE2的同質子,則應尋找多克隆蛋白質。家族性異常乳脂蛋白血症的治療應在專科診所進行。大多數情況下,對他汀治療或如果主要是高三酸甘油酯,則使用fibrate治療效果良好;通常可能需要他汀和fibrate的結合治療。
9.1.4 高三酸甘油酯的遺傳原因
儘管高三酸甘油酯的遺傳學原因似乎非常復雜,但最近的數據已擴展了我們對高三酸甘油酯的遺傳了解,特別是乳糜殘餘的遺傳學。輕度升高的三酸甘油酯水平(在2.0–10.0 mmol/L之間)是由多個基因的多基因效應引起的,這些基因影響VLDL的生成和清除。單基因的嚴重HTG導致乳糜殘餘,胰臟炎和脂質沉積。到目前為止,已經確認了六種具有單基因效應的基因(LPL、apoC2、apoA5、LMF1、GPIHBP1和GPD1),這些基因會破壞乳糜殘餘清除途徑,導致血清三酸甘油酯嚴重升高。這些突變以常染色體隱性方式遺傳,並且很少見。對乳糜殘餘和VLDL的代謝存在嚴重缺陷導致乳糜殘餘,三酸甘油酯水平>11.2 mmol/L (>1000 mg/dL),血清混濁和乳白色。在LPL酶的突變體同質子或複合異質子以及與富含三酸甘油酯脂蛋白代謝相關的其他基因中,可以看到嚴重的HTG。這些相同基因突變的異質子攜帶者通常表現出中度升高的血清三酸甘油酯水平,使其面臨增加的CVD風險。最近,已經開發了LPL缺陷的基因治療並在臨床試驗中進行了測試,而alipogene tiparvovec於2013年獲得EMA批准。但是,這種治療現已不再可用。apoC3的增功能突變會導致高apoC-III水平,通過抑制LPL的活性而引起嚴重HTG,而功能喪失突變則與有利的脂質配置和低三酸甘油酯水平相關。這些發現提出了ApoC-III可能是一個新的脂質藥物靶點的可能性。
9.1.4.1 預防嚴重高三酸甘油酯引發急性胰腺炎的措施。
如果三酸甘油酯(TG)>10 mmol/L(880 mg/dL),特別是在伴隨家族性乳糜殘餘症的情況下,胰腺炎的風險在臨床上是顯著的,因此預防急性胰腺炎的措施是必需的。值得注意的是,高三酸甘油酯是胰腺炎所有病例的原因之一,患者即使三酸甘油酯濃度為5-10 mmol/L(440-880 mg/dL)也可能發展出胰腺炎。最近的前瞻性隊列研究數據報告,急性胰腺炎的風險隨血清三酸甘油酯的四分位數而顯著增加,突顯出作為一個風險因素,血清三酸甘油酯可能被低估了。任何增加VLDL生成的因素都可能加劇胰腺炎的風險,其中酒精攝入是最常見的促成因素。如果有症狀,患者應入院,或者應對患者的三酸甘油酯值進行仔細而密切的隨訪。飲食應限制卡路里和脂肪含量(建議為10-15%),並且應戒酒。應開始使用fibrate治療(費諾費布酮),作為輔助療法,應使用n-3脂肪酸(2-4 g/天)。在嚴重病例中,也可以考慮使用洛米塔皮德。對於糖尿病患者,應開始胰島素治療以達到良好的血糖控制。一般而言,TG值在2-5天內會急劇下降。在急性情況下,血漿置換能夠迅速降低TG水平。最近,歐洲藥品管理局已批准伏利塞爾森作為輔助飲食治療,用於高危急性胰腺炎的遺傳確診FCS成年患者。
9.1.5 脂蛋白代謝的其他遺傳性疾病
有時會遇到LDL-C或HDL-C極低水平的患者。最常見的遺傳低脂血症形式是低載脂蛋白血症,它是顯性遺傳的,通常是由於ApoB的截短引起。血清LDL-C通常在0.5-1.5 mmol/L(20-60 mg/dL)之間。在無脂泄病(abetalipoproteinaemia)中,ApoB的缺陷更為嚴重,需要專科治療,常伴隨脂肪泄瀉、神經或其他併發症。Tangier病(analphalipoproteinaemia)患者的HDL-C水平幾乎不存在,而卵磷脂膽固醇酰轉移酶(LCAT)缺乏症患者的HDL-C水平非常低。這兩種情況都伴隨著明顯的臨床綜合症,需要專科調查。CETP缺陷患者的HDL-C水平非常高。在異質子型中,通常觀察到2.0-2.3 mmol/L(80-90 mg/dL)的水平,而在同質子型中觀察到≥5 mmol/L(≥200 mg/dL)的水平。這與動脈粥樣硬化疾病無關,可能與降低的風險有關。
溶酶體酸性脂酶缺乏症或膽固醇酯儲存疾病(在沃爾曼病的兒童中)是一種罕見的原因(隱性傳遞)導致LDL-C升高和HDL-C降低的疾病,伴隨肝大和微小泡沫肝脂肪變性。他汀治療確實可以降低LDL-C水平,因此可以防止這些患者患動脈粥樣硬化心血管疾病,但無法阻止肝損傷的進展。使用PCSK9抑制劑治療可能會導致溶酶體更大量的過載。sebelipase alfa的酶替代療法可能在不久的將來提供治療方案。
9.2 女性
很少有關他汀治療的隨機試驗報告了女性獨立的明顯心血管益處,主要是因為女性在他汀試驗中的代表性不足。387,389
9.2.1 他汀在初級和次級預防中的效果
以前有爭議,關於他汀是否對女性的初級預防有效。根據已發表的數據,2013年的Cochrane分析顯示,他汀治療降低了初級預防中的全因死亡率、血管事件和血管重建手術率,而女性的比例效應與男性相似。213 CTT合作團隊通過對來自22個他汀對照試驗和5個更多或更少強度的他汀治療對照試驗的個體數據的綜合分析,提供了更全面的證據評估。35 總共,174,149名參與者中有46,675名(27%)是女性,在對非性別差異進行調整後,主要心血管事件、主要冠心病事件、冠狀動脈重建和中風每毫摩爾/升LDL-C降低的比例在女性和男性中相似。35
9.2.2 非他汀類降脂藥物
現在有關降低LDL-C的非他汀類藥物的心臟保護作用的明確證據,且在女性和男性中的益處相似。在IMPROVE-IT研究中,將依智利比添加到辛伐他汀的相對益處在女性和男性中相似。33 在ACCORD脂質研究中,並無證據顯示非他汀類藥物非食酸添加到二型糖尿病患者的辛伐他汀治療效果中,306 但對FIELD研究的分析顯示,在女性和男性中一致降低心血管事件。389 現在已經報告了幾個評估在高強度他汀治療中添加PCSK9抑制劑效果的結果試驗,女性和男性的主要心血管事件比例降低相似。120,286,290
9.2.3 賀爾蒙療法
目前開立的第三代低劑量雌激素-孕激素口服避孕劑似乎不會增加不良冠心疾病事件,可以在基線血脂檢測後,用於血總膽固醇水平可接受的女性。相反,對於有高膽固醇血症[LDL-C >4 mmol/L (>160 mg/dL)]或有多個危險因素的女性,以及那些有高血栓事件風險的女性,應推薦使用其他避孕措施。儘管對血脂概況有一些有利的影響,但已經未能證明雌激素替代療法能夠降低心血管風險,不能推薦用於女性的CVD預防。392 在懷孕期間和哺乳期間不應使用任何降脂藥物,因為缺乏有關可能不良影響的數據。但可以考慮使用膽酸螯合劑。
9.3 高齡人群
社會上高齡人口(在此定義為65歲以上的人)的比例正在增加,因此,>80%由於心血管疾病而死亡的個體年齡在65歲以上。>85歲的心肌梗塞患者的比例增加了數倍。393
一項對觀察性研究的荟萃分析顯示,較高的總膽固醇水平與各個年齡段的冠心疾病死亡率增加有關。62,394 然而,由於老年人冠心疾病的絕對風險更高,所以對於總膽固醇的每一個增量,隨著年齡的增加,相關風險的絕對增加也更大。217
9.3.1 初級和次級預防中的他汀藥效
隨著年齡的增長,他汀藥物治療的使用率下降,這反映了處方和遵循的不同。395,396 這一趨勢在沒有閉塞性血管疾病證據的老年患者中更加明顯。396 這種模式的一種解釋可能是對於他汀藥物在老年人中的效果存在不確定性,因為參加他汀藥物試驗的>75歲人數相對較少。233,397,398 CTT合作組織最近對不同年齡組別的他汀藥物治療效果提供了全面評估。在28個試驗的186,854名參與者中,有14,483名(8%)在隨機分組時年齡>75歲。總體而言,他汀藥物治療使主要血管事件(相對風險0.79,95% CI 0.77-0.81)減少21%,每1.0 mmol/L的LDL-C降低,並且在年齡>75歲的人中有明確的效益證據。對於具有已知血管疾病的患者來說,無論年齡如何,主要血管事件的相對減少都是相似的,但對於年紀較大的未知患有血管疾病的人來說,效益似乎較小。因此,來自試驗的現有證據表明,無論年齡如何,他汀藥物治療都能夠明顯減少主要血管事件。然而,目前對於年齡>75歲且尚未有閉塞性血管疾病證據的患者,效益的直接證據較少,澳大利亞正在進行的STAREE試驗目前正在解決這一局限性。
9.3.2 不良反應、相互作用和依從性
對於老年人來說,他們常常伴隨著合併症、服用多種藥物,以及藥代動力學和藥效動力學的改變,他們對於他汀類藥物的安全性和不良反應是特別關切的問題。他汀類藥物與其他藥物的相互作用是一個問題,主要是因為它們有可能增加肌肉相關的他汀類藥物不良反應,如無肌酸激酶升高的肌肉痛、伴隨著肌酸激酶升高的肌肉病和罕見但嚴重的肌肉溶解症。建議如果存在明顯的腎功能受損和/或藥物相互作用的可能性,應以低劑量開始使用他汀類藥物,然後逐漸增加劑量以達到LDL-C治療目標。
9.4 糖尿病和代謝綜合症
患有糖尿病(DM)的人數將從今天的約4.15億增加到2030年的5.5億,但情況可能會變得更糟。儘管在減少動脈粥樣硬化心血管疾病(CVD)風險因素方面的管理策略方面存在顯著優勢,但CVD仍然是T2DM患者中發病率和死亡率最高的主要原因。好消息是,在1998年至2014年間,T1DM和T2DM患者的致命CVD結果明顯下降。DM本身是CVD的獨立風險因素,尤其在女性中風險更高。在過去幾十年中,患有DM和未患有DM的個人之間的CVD風險差異已經大大縮小,DM和血管結果之間存在著強烈的關聯。最近的數據顯示,DM本身平均增加了約兩倍的CVD風險,但風險根據人口和當前積極的預防治療而有很大變化。重要的是,患有DM和CAD的人在未來事件中CVD風險顯著更高。在T2DM中,ASCVD的風險強烈受到目標器官損傷的影響,包括腎病(微白蛋白尿)、神經病或視網膜病變,風險與存在的疾病數量呈正比增加。高血壓、血脂異常、腹部肥胖和非酒精性脂肪肝疾病(NAFLD)常與T2DM同時存在,進一步加劇了風險,尤其是患有T2DM和多種心臟代謝風險因素的人。重要的是,儘管現代治療,但在ACS之後,DM患者的超額死亡風險仍然很高,突顯了T2DM冠心病患者的不良預後和需要強化治療。如何在臨床實踐中捕捉超越傳統風險因素的額外風險是一個有爭議的問題。一種實際的方法是,如果識別到一個組件,應該系統性地尋找其他組件。
9.4.1 糖尿病和第二型糖尿病中胰島素抵抗的脂質異常的特點
糖尿病性脂質異常是一種代謝相互關聯的血漿脂質和脂蛋白異常的簇集。第二型糖尿病(T2DM)中大型VLDL粒子的增加引發了一系列事件,生成了致動脈粥樣硬化殘餘物、小而致密的LDL以及富含小而致密的HDL粒子。這些成分不是孤立的異常,而是彼此緊密相關的。LDL和HDL粒子都顯示出可變的組成變化,反映在它們的功能中。值得注意的是,T2DM患者的ApoC-III水平增加。高濃度的ApoC-III會阻礙TRLs和殘餘物的清除,導致這些粒子在循環中的滯留時間延長。實際上,TRLs的缺陷代謝似乎比增加的產量導致殘餘粒子過多更重要。總之,TRL殘餘物、小而致密的LDL和小而致密的HDL構成了致動脈粥樣硬化脂質配置文件,其特點還包括由於增加的ApoB含有粒子數量而導致的ApoB濃度上升。重要的是,TRLs,包括乳糜微粒、VLDL和它們的殘餘物,攜帶單個ApoB分子,就像LDL粒子一樣。因此,糖尿病性脂質異常的惡性性質並不總是由臨床實踐中使用的脂質測量所顯示,因為LDL-C水平可能仍在正常範圍內。非HDL-C水平可能更好地顯示出這種異常。在約一半的T2DM患者中,可以在禁食或進食後狀態下觀察到TG升高或HDL-C水平降低,這也常常存在於腹部肥胖、胰島素抵抗或糖耐受受損的人中。
9.4.2 降脂治療的證據
9.4.2.1 低密度脂蛋白膽固醇
在患有糖尿病(DM)的患者中,低密度脂蛋白膽固醇(LDL-C)是降脂治療的主要目標。在特別針對第二型糖尿病(T2DM)患者進行的試驗以及主要他汀試驗中的DM患者亞組中,一致表明他汀治療對T2DM患者的CVD事件有顯著的益處。根據荟萃分析,每1 mmol/L的LDL-C降低將使5年內主要CVD事件的發生率減少23%,不論初始LDL-C水平或其他基線特征如何。荟萃分析進一步指出,T2DM患者的相對風險減少將與非糖尿病患者相當,但由於絕對風險更高,絕對益處將更大,從而降低了需要治療的人數(NNT)。因此,他汀治療是降低LDL-C和減少CVD負擔的一線治療。
依智米(Ezetimibe)通過降低LDL-C約24%,並在添加到他汀治療時減少了主要血管事件的風險。主要血管事件的相對風險減少與LDL-C降低的絕對程度成比例,與他汀藥的關系一致。在IMPROVE-IT試驗中,DM患者的主要血管事件發生率高於無DM的患者,這是預期的(安慰劑組中7年Kaplan-Meier速率為46%對31%)。依智米在DM患者中表現特別有效,相對風險減少為15%(95% CI 6-22%),絕對風險減少為5.5%。
單克隆抗體PCSK9抑制劑埃伏莫卡(evolocumab)和阿利洛卡(alirocumab)可降低LDL-C水平約60%,並在添加到他汀治療時減少主要血管事件的風險。在FOURIER研究中,DM患者的主要血管事件的相對風險減少與無DM的患者相似;然而,由於DM患者基線風險較高,絕對風險減少在DM患者中更明顯(3年內主要血管事件的絕對減少為2.7%)。值得注意的是,埃伏莫卡組的實現LDL-C為0.8 mmol/L。相同的好處最近也在ODYSSEY試驗中證實,該試驗針對ACS後的糖尿病患者進行。
最近的研究表明,在接受他汀治療的患者中糖尿病的發病率增加。這些觀察結果在Mendelian隨機化研究和臨床試驗中都有看到,儘管在已經具有高糖尿病風險的患者中效果最大(例如,那些患有糖尿病前期的患者)。儘管糖尿病的發生率增加,但這些觀察結果不應減輕我們對患者治療的關注,因為在降低心血管事件方面的整體好處仍然遠遠超過糖尿病發生率的增加。在隨機對照試驗中,依智米和PCSK9抑制劑都未報告增加糖尿病風險。
9.4.2.2 三酸甘油脂和高密度脂蛋白膽固醇
由於其多面性作用,生活方式改變提供了改善致動脈粥樣硬化脂質異常的第一選擇。體重減輕在大多數情況下是最有效的措施,因為它與血漿三酸甘油脂(TG)和高密度脂蛋白膽固醇(HDL)水平的非常明顯的效應相關,同時伴隨較小的總膽固醇(TC)和低密度脂蛋白膽固醇(LDL-C)水平下降。適度至重度的有氧運動也與改善血漿脂質配置文件相關,通過降低TG水平並增加HDL-C濃度。關於飲食組成,除了需要消除反式脂肪外,有可用的證據支持減少飽和脂肪攝入並以不飽和脂肪替代,以及將大部分精製澱粉食物和簡單糖替換為富含纖維的食物,如水果、蔬菜和全穀物。
對於高TG和低HDL-C水平的治療(在DM中經常見到)所取得的臨床益處仍有爭議,因為芬費布拉特治療對主要結局(MACE)的效果在FIELD和ACCORD試驗中均為負面,在T2DM群體中進行。在FIELD研究的事後分析中,芬費布拉特降低了高TG(約2.3 mmol/L或200 mg/dL)和高HDL-C水平(NNT = 23)的患者的CVD事件發生率27%。ACCORD試驗確認了以下事實:那些TG水平處於高三分之一(約2.3 mmol/L或200 mg/dL)並且HDL-C水平處於低三分之一(≤0.4 mmol/L或≤34 mg/dL)的患者,佔所有參與者的17%,似乎從添加芬費布拉特到席伐他汀中受益。最近,ACCORD脂質試驗參與者的事後試驗報告了芬費布拉特對基線高TG和低HDL-C水平的人的有益影響。與這些發現一致的是,在針對T2DM患者的11,590人的CVD預防中,纖維素的荟萃分析顯示,纖維素顯著降低了非致命性心肌梗塞的風險21%,但對總體死亡率或冠心病死亡風險沒有影響。在纖維素的CV結果試驗中,風險減少似乎僅與非HDL-C降低程度成正比。
總的來說,現有數據表明,患有致動脈粥樣硬化脂質異常的糖尿病患者可能會從降低TG療法中獲得臨床益處,作為他汀治療的附加治療。正在進行的PROMINENT試驗探討了新的選擇性PPAR-α調節劑培美費布拉特在席伐他汀上減少CVD結果的功效,約有10,000名患有致動脈粥樣硬化脂質異常的糖尿病患者參加。對於在接受他汀治療的TG水平高且正在接受他汀治療的高TG水平患者添加omega-3脂肪酸的心血管影響的數據有限。REDUCE-IT試驗研究了8179名高危患者中icosapent ethyl 2 g b.i.d.對CV事件的影響,這些患者患有HTG並正在接受他汀治療。在4.9年的中位數內,主要復合結局(CV死亡、非致命性心肌梗塞、非致命性中風、冠狀動脈重建或不穩定心絞痛)的組合主要結局顯著減少(P <0.001),減少了25%,相應的絕對減少為4.8%,但被房顫或心房撲動住院風險增加了1%。STRENGTH試驗正在研究omega-3脂肪酸的效應,除了他汀治療外,還包括HTG和低HDL-C水平且具有高CVD風險的個體。ASCEND試驗是一項關於對有DM但沒有特別HTG的人進行初級預防心血管事件的阿斯匹林和omega-3脂肪酸補充劑的隨機2×2因子設計研究。在15,480名被隨機分配到omega-3脂肪酸補充劑組和安慰劑組的人中,平均隨訪7.4年,對嚴重血管事件(非致命性心肌梗塞、非致命性中風、短暫性腦缺血發作(TIA)或血管性死亡)沒有明顯影響(HR 0.97,95% CI 0.87-1.08)。
9.4.3 第1型糖尿病
T1DM與高CVD風險相關,特別是在具有微量白蛋白尿和腎臟疾病的患者中。有確定證據支持高血糖加速動脈粥樣硬化的命題。新出現的證據突顯了MetS與T1DM的頻繁共存,從而增加了CVD風險,這被稱為雙糖尿病。
在T1DM患者中,良好的血糖控制的脂質配置文件是“超正常的”,其特點是次正常的三酸甘油脂(TG)和低密度脂蛋白膽固醇(LDL-C)水平,而高密度脂蛋白膽固醇(HDL-C)水平通常在正常上限範圍內或稍微升高。這是由皮下注射胰島素增加了脂肪組織和骨骼肌中脂蛋白酶(LPL)活性,因此增加了VLDL顆粒的周轉速率所解釋的。然而,HDL和LDL顆粒的組成都存在潛在的致動脈粥樣硬化變化。
一致的數據已經證明了他汀藥物在預防DM患者的CV事件和降低CV死亡方面的功效,並且沒有性別差異的證據。包括18,686名DM患者的荟萃分析顯示,他汀藥物降低LDL-C的效果使每降低1.0 mmol/L(40mg/dL)的LDL膽固醇,全因死亡率減少9%,主要CV事件的發生率減少21%。相似的益處也在T1DM和T2DM患者中觀察到。在患有ACS的糖尿病患者中,強化的他汀治療導致了全因死亡和CV死亡的降低,並有助於動脈粥樣硬化的進展減緩。
9.4.4 懷孕的糖尿病婦女的脂質異常管理
在T1DM和早發T2DM患者中,缺乏證據表明應該在何時開始他汀治療。為了引導一種方法,懷孕期間不應使用他汀,並且在計劃懷孕的T1DM和T2DM患者中應避免使用。如果年齡≤30歲的糖尿病患者沒有血管損傷的證據,特別是微量白蛋白尿,似乎合理延遲無症狀患者的他汀治療直到30歲。在這個年齡以下,應該根據病例,考慮微量白蛋白尿,器官損傷和環境LDL-C水平。



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย