本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
近期研究顯示,糖尿病患者常見的脂肪增生問題可能導致胰島素吸收與作用減弱。該研究指出,相較於正常脂肪組織,脂肪增生區域的胰島素注射會使吸收效率和血糖控制能力明顯下降,並增加變異性,為糖尿病治療帶來新的挑戰。
胰島素注射至脂肪增生組織:胰島素吸收和作用的減弱和變異性增加,以及餐後血糖控制受損
Insulin Injection Into Lipohypertrophic Tissue: Blunted and More Variable Insulin Absorption and Action and Impaired Postprandial Glucose Control
https://doi.org/10.2337/dc16-0610
摘要
目的
脂肪增生(LHT)常見於接受胰島素治療的患者,但其對胰島素吸收和作用的確切影響尚不清楚。
研究設計和方法
在這個交叉研究中,13位1型糖尿病患者在腹部皮下接受了0.15單位/公斤的胰島素利普羅注射到LHT(經檢查和超聲確認)和正常脂肪組織(NAT)。在某一天,進行了一個等血糖夾鉗實驗,每個區域分別在LHT和NAT中注射兩次,另一天在隨機順序下在標準化混合餐(75克碳水化合物)前每個區域注射一次。
結果
與NAT相比,LHT減少了胰島素吸收(胰島素濃度曲線下平均面積[AUCINS0–4h] 131 vs. 165小時* mU/L [LHT vs. NAT];Cmax 61 vs. 79 mU/L,P < 0.02)和效果(葡萄糖輸注速率[GIR]曲線下面積[AUCGIR0–4h 625 vs. 775 mg/kg,P < 0.05]),但增加了主體內變異性([變異係數] AUCINS0–4h 52 vs. 11%,Cmax 55 vs. 15%,AUCGIR0–4h 57 vs. 23%,所有P < 0.01)。LHT的餐後血糖(BG)濃度高於26%(AUCBG0–5h 731 vs. 513 mg * h/dL,BGmax 199 vs. 157 mg/dL,2小時BG 150 vs. 104 mg/dL,5小時BG 145 vs. 81 mg/dL,所有P < 0.05),並且最大濃度出現較晚。與LHT注射數值上較少發生低血糖(BG ≤50 mg/dL)(兩位患者對六位患者),而嚴重高血糖(BG ≥300 mg/dL)僅在LHT注射時發生(兩位患者)。Tmax-INS在兩項研究中的LHT和NAT之間沒有差異。
結論
LHT注射後胰島素吸收和作用受到減弱並且變異性顯著增加,導致餐後血糖控制嚴重惡化。
ABSTRACT
OBJECTIVE
Lipohypertrophy (LHT) is common in insulin-treated patients but its exact impact on insulin absorption and action is unclear.
RESEARCH DESIGN AND METHODS
In this crossover study, 13 patients with type 1 diabetes received subcutaneous abdominal injections of 0.15 units/kg insulin lispro into LHT (confirmed by examination and ultrasound) and normal adipose tissue (NAT). On one day, a euglycemic clamp was performed with two injections each into LHT and NAT, and on another day one injection per region was given before a standardized mixed meal (75 g carbohydrates), all in randomized order.
RESULTS
Compared with NAT, LHT reduced insulin absorption (mean area under the insulin concentration curve [AUCINS0–4h] 131 vs. 165 h * mU/L [LHT vs. NAT]; Cmax 61 vs. 79 mU/L, P < 0.02, respectively) and effect (areas under glucose infusion rate [GIR] curves [AUCGIR0–4h 625 vs. 775 mg/kg, P < 0.05]) but increased intrasubject variability ([coefficient of variation] AUCINS0–4h 52 vs. 11%, Cmax 55 vs. 15%, AUCGIR0–4h 57 vs. 23%, all P < 0.01). Postprandial blood glucose (BG) concentrations were ≥26% higher with LHT (AUCBG0–5h 731 vs. 513 mg * h/dL, BGmax 199 vs. 157 mg/dL, 2-h BG 150 vs. 104 mg/dL, 5-h BG 145 vs. 81 mg/dL, all P < 0.05) and maximum concentrations occurred later. Hypoglycemia (BG ≤50 mg/dL) occurred numerically less frequently with LHT injection (two vs. six patients), whereas profound hyperglycemia (BG ≥300 mg/dL) only occurred with LHT injection (two patients). Tmax-INS did not differ between LHT and NAT in either study.
CONCLUSIONS
Insulin absorption and action are blunted and considerably more variable with LHT injection, leading to profound deterioration in postprandial glucose control.
引言
脂肪增生(LHT)是長期胰島素治療患有糖尿病患者的常見副作用,其特點是皮下脂肪組織中的纖維化和血管化不良的病變(1)。來自德國、埃塞俄比亞、土耳其和西班牙等不同國家的橫斷面研究報告了28%到64%以上的患病率,這在1型和2型糖尿病患者之間均有出現;在1型糖尿病患者中更為常見(2-5)。雖然LHT的確切病因尚不清楚,但易感因素包括胰島素治療的持續時間、針頭重複使用的頻率,特別是由於注射和部位旋轉技術不正確,而導致反复注射到相同組織區域(1,5)。
一些臨床觀察強烈表明,LHT會對胰島素的吸收產生不良影響。在重新教育注射部位旋轉技巧並避免用於胰島素注射的LHT後,患者的血糖(BG)控制明顯改善,並減少了胰島素劑量(6)。Blanco等人(4)觀察到,與沒有LHT的患者相比,患有LHT的患者的胰島素劑量顯著較高,但未報告A1C水平。另一方面,一項橫斷面研究(2)中沒有發現患有和未患有LHT的患者之間的糖尿病控制或胰島素需求的差異,並且一項門診3天連續血糖監測研究未能顯示胰島素藥代動力學(PK)和BG分佈的任何實質差異(7),因此那些作者認為不必勸告患者避免用於胰島素注射的LHT。此外,兩項用餐研究通過胰島素注射到LHT與正常脂肪組織(NAT)的藥代動力學(PD)和PK比較顯示了不一致的結果。雖然LHT注射降低了25%到30%的最大胰島素濃度,但PD變量並未顯著不同(7,8)。然而,使用葡萄糖夾子技術的系統研究從未量化LHT對胰島素PK/PD的影響,也未調查胰島素PK/PD的變異性。
因此,我們進行了結合葡萄糖夾子/膳食測試研究,以量化LHT對胰島素吸收和作用的程度和變異性的影響。
研究設計和方法
試驗設計和試驗人群
脂肪增生(LHT)是長期胰島素治療患有糖尿病患者的常見副作用,其特點是皮下脂肪組織中的纖維化和血管化不良的病變(1)。來自德國、埃塞俄比亞、土耳其和西班牙等不同國家的橫斷面研究報告了28%到64%以上的患病率,這在1型和2型糖尿病患者之間均有出現;在1型糖尿病患者中更為常見(2-5)。雖然LHT的確切病因尚不清楚,但易感因素包括胰島素治療的持續時間、針頭重複使用的頻率,特別是由於注射和部位旋轉技術不正確,而導致反复注射到相同組織區域(1,5)。
一些臨床觀察強烈表明,LHT會對胰島素的吸收產生不良影響。在重新教育注射部位旋轉技巧並避免用於胰島素注射的LHT後,患者的血糖(BG)控制明顯改善,並減少了胰島素劑量(6)。Blanco等人(4)觀察到,與沒有LHT的患者相比,患有LHT的患者的胰島素劑量顯著較高,但未報告A1C水平。另一方面,一項橫斷面研究(2)中沒有發現患有和未患有LHT的患者之間的糖尿病控制或胰島素需求的差異,並且一項門診3天連續血糖監測研究未能顯示胰島素藥代動力學(PK)和BG分佈的任何實質差異(7),因此那些作者認為不必勸告患者避免用於胰島素注射的LHT。此外,兩項用餐研究通過胰島素注射到LHT與正常脂肪組織(NAT)的藥代動力學(PD)和PK比較顯示了不一致的結果。雖然LHT注射降低了25%到30%的最大胰島素濃度,但PD變量並未顯著不同(7,8)。然而,使用葡萄糖夾子技術的系統研究從未量化LHT對胰島素PK/PD的影響,也未調查胰島素PK/PD的變異性。
因此,我們進行了結合葡萄糖夾子/膳食測試研究,以量化LHT對胰島素吸收和作用的程度和變異性的影響。
在兩個治療時期中,患者重複接受每公斤體重0.15單位的insulin lispro(Humalog;Lilly Deutschland GmbH,Bad Homburg,德國)注射。在葡萄糖夾子期間,進行了四次劑量,兩次進入LHT和兩次進入NAT,而患者在MMTT期間接受了兩次insulin lispro注射(分別進入LHT和NAT各一次)。注射部位(LHT或NAT)是通過隨機分配到兩個單獨治療時期的六次劑量管理的12個序列之一來確定的(補充圖3)。
等葡萄糖葡萄糖夾子
患者在至少10小時的隔夜禁食後早上抵達研究現場。患者必須洗掉他們的背景胰島素,以便研究日的最後注射和劑量之間的最短時間為insulin degludec的72小時,glargine和detemir的48小時,NPH胰島素的16小時,以及波浪注射的12小時。患者最多可以在第一次劑量前6小時使用6 IU的普通人類胰島素。使用人類胰島素的患者在第一次劑量前6小時停止基礎胰島素輸注速率,或使用胰島素類似物3小時。
患者連接到Biostator(MTB Medizintechnik,Amstetten,德國)以進行連續BG測量和葡萄糖輸注,如之前所述(9)。通過靜脈輸注葡萄糖或人類胰島素(Actrapid;Novo Nordisk,Bagsvaerd,丹麥)穩定患者的BG,夾子目標水平為100 mg/dL,在劑量前的最後30分鐘內允許的變異性為±10 mg/dL。需要在劑量前至少停止1小時的葡萄糖輸注,至少停止20分鐘的胰島素輸注。
在第一次insulin lispro注射後,Biostator連續測量BG水平,並每分鐘自動調整葡萄糖輸注速率(GIR),以保持BG在目標水平。至少每30分鐘使用參考系統(Super GL葡萄糖分析儀;Dr. Müller Gerätebau GmbH,Freital,德國)檢查設備的BG測量,並在需要時進行調整。每次lispro注射前和15、30、45、60、80、100、120、150、180、210、240和300分鐘後,取得血清樣本以確定insulin lispro水平。如果患者的BG在最後15分鐘內持續增加到118 mg/dL以上,並且沒有任何GIR,則開始人類胰島素的靜脈輸注,以重新穩定BG到目標水平。當上述目標(±10 mg/dL)在沒有GIR或胰島素輸注的情況下重新建立時,給予insulin lispro的下一次注射,但在上一次劑量給藥後不早於6小時。對insulin lispro的PK取樣始終在每次注射後的5小時內持續,即使在“搶救”人類胰島素輸注的情況下也是如此。
MMTT
對於MMTT,患者需要禁食至少10小時,並像葡萄糖夾子測試一樣清洗他們的背景胰島素。通過靜脈葡萄糖或胰島素輸注,患者的BG穩定在100 mg/dL ± 20 mg/dL的水平。同樣,從1小時開始,不允許GIR,並且在insulin lispro給藥前20分鐘內不允許胰島素輸注,該給藥是在開始用餐之前立即完成的。兩個MMTT間隔的膳食相同,主要由75克迅速可吸收的碳水化合物(膳食能量含量的56%)、20.2克脂肪(33%)和15.2克蛋白質(11%)組成。膳食必須在15分鐘內完全消耗。從MMTT開始的1小時前到2小時後,除了用餐時提供的液體外,不允許飲用水。在給藥後的5小時內,頻繁地測量BG和PK樣本。如果出現低血糖(BG≤50 mg/dL)或高血糖(BG>300 mg/dL超過30分鐘),MMTT將提前停止,此時患者將接受葡萄糖或人類胰島素的“搶救”靜脈輸注。否則,在第一次insulin給藥後的5小時內,如果需要,通過靜脈葡萄糖或人類胰島素輸注重新穩定患者的BG水平到目標水平。第二個MMTT在第一次insulin lispro給藥後至少6小時進行,並且在沒有GIR和胰島素輸注的情況下BG穩定在目標水平之前不進行。在所有實驗期間,患者保持平躺/半躺姿勢。
分析方法
血清胰島素濃度是使用專門針對insulin lispro的競爭結合放射免疫分析來確定的(LisPro Insulin RIA Kit;Millipore Inc.,聖查爾斯,MO;檢測限度:2.50 mU ⋅ L−1,定量下限:5.00 mU−1,定量上限:250.000 mU ⋅ L−1,變異係數[CV]≤20%,相對誤差≤25%)。
統計分析和終點
WinNonlin(版本6.3)用於分析PK參數,而SAS系統用於Windows(版本9.4)用於所有其他統計計算。主要終點是夾持測試後的前4小時胰島素濃度和GIR曲線下面積(AUCINS0–4h和AUCGIR0–4h)。主要次要終點是AUCINS0–4h以及MMTT期間的BG激增曲線下的面積(AUCBG0–4h),以及夾持檢查期間AUCINS0–4h和AUCGIR0–4h的受試者內變異性(表示為CV)。統計分析基於所有隨機分配的患者和實驗(完全分析集),並基於意向治療原則。使用重複測量ANOVA分析對數轉換的主要PK和PD終點,並使用劑量間隔和管理區域(LHT或NAT)作為固定效應,並將受試者作為隨機效應。使用加權局部回歸技術(LOESS,平滑因子0.3)平滑GIR曲線,以分析與時間相關的PD夾持參數和最大GIR。使用ANOVA分析MMTT相關的PK和PD終點,並使用序列、劑量間隔和管理區域作為固定效應,並將受試者在序列內作為隨機效應。由於低血糖或高血糖的“救援”干預,選擇了最後觀察向前攜帶方法進行BG分析。使用受試者作為隨機因子和對數轉換數據,通過使用一般線性模型計算夾持期間PK和PD終點的受試者內CV。使用Wilcoxon符號秩檢驗非參數地分析MMTT的時間相關參數。使用0.05的α水平進行ANOVA推導的最小二乘均值的統計比較。文本和表格中報告的數據是平均值±標準偏差;圖表顯示平均值±標準誤。
樣本大小是基於主要終點LHT和NAT注射之間至少20%的差異以及21%的CV(10)。需要11名患者完成該研究,以展示具有80%的功效的顯著差異。另外招募了兩名患者以彌補潛在的退出。
結果
等血糖鉗試驗
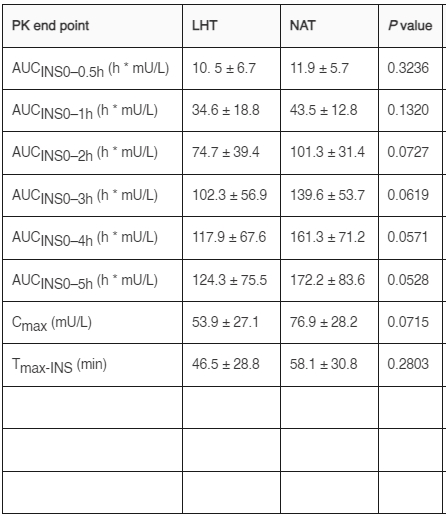
LHT對胰島素lispro的吸收在給藥後的前30分鐘內與NAT顯示類似的模式,但隨後明顯減弱(圖1A)。同樣,LHT和NAT注射後的GIR曲線在30分鐘後明顯分開,LHT的PD效果較低(圖1B)。因此,主要的PK和PD終點(AUCINS0–4h和AUCGIR0–4h)在NAT與LHT注射之間顯著更高(分別為26%和24%),Cmax(28%)和給藥後1小時的所有部分PK AUC也是如此(表1)。基於AUCINS0–5h和AUCGIR0–5h的總生物利用度和總生物效能在LHT注射時明顯降低,為NAT注射效果的78-80%(表1)。雖然LHT注射的其他GIR和GIRmax的AUC數值較低,但這些差異均未達到統計學意義(表1)。LHT和NHT之間的最大胰島素濃度時間沒有差異,而最大作用時間(Tmax-GIR)在LHT注射後呈現較晚的趨勢(P < 0.10)(表1)。
圖1血糖鉗實驗的PK和PD結果。A:校正基線後的平均血清胰島素濃度剖面。B:LHT或NAT區域中胰島素lispro注射後的平均GIR剖面。誤差棒為SEM。下方的面板顯示PK參數(C)和PD參數(D)的受試者內變異CV(%)。星號表示統計學上顯著的差異(P < 0.05)。
圖表1血糖鉗試驗中的PK和PD終點。在血糖平穩超胰島素血糖鉗試驗中的藥物動力學(PK)和藥效學(PD)終點。


結果以平均值 ± 標準差表示。
夾持品質參數位於先前報告的自動葡萄糖夾持範圍內。血糖(BG)與目標的平均偏差為 2.0 ± 9.0 mg/dL,夾持期間的BG變異係數(CV)為 7.1 ± 4.1%,而在完整的5小時觀察時間內,血糖主要保持在100 mg/dL的目標水平之後(補充圖1)。LHT治療組夾持期末血糖水平的略微上升是由於血糖濃度超過了預定的停止水平118 mg/dL,表示胰島素作用結束(11)。這在五次LHT注射(四名患者中)後發生,但在NAT注射後只發生一次。
與NAT注射相比,LHT注射的PK和PD參數的個體內變異性明顯較高。與NAT的11-20%相比,LHT的PK參數的CV範圍從52%到65%(圖1C)。PD變異性普遍高於PK變異性,特別是在注射後的第一小時,當LHT注射的CV達到90%,而NAT為66%。對於主要PD終點AUCGIR0–4h,PD變異性顯著不同(圖1D)。
MMTT
儘管波動較大,但在MMTT後獲得的PK曲線與葡萄糖夾持測試中觀察到的PK曲線大致相似(圖2B)。同樣,與LHT注射相比,NAT注射後的血清胰島素水平較高,這表明AUCINS0–4h和AUCINS0–5h增加了37-39%,以及最大濃度增加了43%,其統計意義處於邊緣水平(表2)。
圖2MMTTs的PK和PD結果。A:平均BG剖面。B:胰島素lispro注入LHT或NAT區域後,隨時間變化的平均血清胰島素濃度剖面。誤差棒為SEM。
圖表1MMTTs的PK和PD終點

與較低的血清胰島素濃度一致,與NAT注射相比,LHT注射後平均餐後血糖濃度較高(圖2A),特別是從注射後1小時開始,由血糖(AUCBG0-2h到AUCBG0-5h)的顯著更高的AUCs、更高和更晚的BGmax,以及注射後2至5小時的升高的餐後血糖濃度和更高的AUCs所示。
餐後低血糖(BG ≤50 mg/dL)在NAT注射中數值上更常見,而不是LHT注射(六個患者對比兩個患者,P = 0.2016,Fisher確切檢驗)。相反,餐後高血糖(BG> 300 mg/dL)在兩次LHT注射後發生,但在NAT注射中未觀察到。
個體PK數據的檢查顯示兩個患者在LHT注射的兩個夾持檢查和MMTT中始終沒有或只有非常低的胰島素lispro濃度,吸收模式與其他患者的NAT注射相似(數據未示)。這兩個患者是MMTT中唯一經歷BG> 300 mg/dL的高血糖的患者,並需要“救援”胰島素輸液。
結論
這項研究的目的是精確量化LHT對皮下注射胰島素lispro的PK / PD特性及其變異性的影響。與NAT注射相比,LHT注射的胰島素lispro的吸收和作用都受到抑制,變異性大大增加,導致混合餐後餐後血糖波動顯著增加。
LHT的胰島素吸收受到抑制的觀點得到了較早使用放射性標記的胰島素的數據支持,這些胰島素比沒有LHT的部位慢更多地從LHT部位清除(12)。此外,一些病例研究報告了在患者被教導避免用於胰島素注射的LHT區域時,血糖控制(A1C降低> 2%)的重大改善,以及更低的胰島素劑量(最多10%)(6,13,14)。的確,Grassi等人。 (15)最近報告了在被教導避免這些區域和旋轉注射部位的LHT患者中,A1C減少了近0.6%,胰島素劑量在3個月內減少了少量(2單位)。然而,該研究是無對照的,並且有25%的研究參與者隨訪丟失。
其他先前發表的研究未檢測到LHT對糖尿病控制的相關影響。Hauner等人。 (2)報告了具有和不具有LHT的患者的類似A1C水平和胰島素需求,以及小型1型糖尿病患者(n = 8和n = 9)的另外兩個膳食測試研究只顯示了LHT和NAT注射之間的小,主要無顯著差異(7,8)。由於樣本量有限和預測BG水平之間的差異很大(7),這些研究可能容易出現第2型統計錯誤。
我們的研究不僅由於樣本量較大而具有更高的統計能力,而且還使用了等葡萄糖血糖夾持技術作為胰島素PD(17)評估的先進方法,其精確度高於膳食測試。此外,我們在夾持測試期間複製了LHT和NAT的注射,從而進一步提高了統計能力並允許確定個體內變異性。我們還通過持續胰島素治療的一致洗脫方案以及特別是通過將BG緊密調整到餐前100 mg / dL的水平來標準化注射前的條件。在MMTT中,我們觀察到餐後BG曲線在30分鐘後分離,導致從2小時開始的BG水平有顯著差異,以及最大餐後BG濃度。這些BG差異凸顯了我們研究中葡萄糖夾持數據的臨床影響,即LHT注射的PK / PD反應受到抑制並且胰島素可變性顯著增加。最近在四個中國城市的401名患者中的觀察研究發現53.1%的LHT患病率;與沒有LHT的患者相比,LHT患者的A1C水平高0.5%,儘管每天需要接近三分之一更多(0.13單位/ kg,31.7%)的胰島素,這與此處示出的LHT區域胰島素吸收受損一致。
在個別患者中,LHT對胰島素PK / PD的影響,以及因此對糖尿病控制的影響可能更為極端。我們的兩名患者在LHT注射後幾乎沒有PK / PD反應,無論是在夾持還是在MMTT中都是如此。相反,他們的NAT注射的PK / PD反應與其他患者觀察到的反應相似。兩位患者在MMTT中的LHT注射後都出現了高血糖,這突顯了避免用於胰島素注射的LHT病變對糖尿病控制的潛在影響,至少在這些個體中。
用胰島素注射到LHT的潛在不良臨床結果可能不僅是由於胰島素吸收和作用的障礙(可以通過使用更高劑量的胰島素來解決),還可能包括胰島素吸收的可變性增加,導致不規則和不可預測的BG濃度阻礙胰島素滴定(4,6,14,18)。在本研究中觀察到的胰島素變異性惡化相當可觀。與NAT注射(11-20%)相似的PK變異與先前報告的快速作用型胰島素類似物的數據相似(10),但是與LHT注射相比增加了三到五倍。高葡萄糖變異性已被確定為嚴重低血糖的重要預測因子(19),而且在Blanco等人的研究中,LHT患者中經常出現的無法解釋的低血糖大約是六倍更常見。 (4),與此處報告的PK / PD觀察結果一致。我們的數據表明,一個相對簡單的程序,即教育患者避免將胰島素注射到LHT並練習良好的注射部位輪換,既可以改善胰島素吸收(降低每日胰島素消耗)也可以減少胰島素作用的可變性;後者似乎對於安全地加強葡萄糖控制至關重要(20)。
LHT病變的組織學發現以肥大的脂肪細胞(13)為特徵,通常血管化減少(1,21)和毛細血管密度降低(22,23)。注射部位的毛細血管減少可能有助於減少胰島素吸收,也增加了可變性(胰島素攝取可能隨著皮下胰島素庫存與毛細血管的接近程度而變化)。由LHT病變在篩選程序中使用的超聲檢查中的弥散,高回聲外觀也表明脂肪密度較高。LHT通常以可觸及的皮下病變為特徵,可能可見或不可見。在長期使用胰島素的人中,僅通過觸診就很難區分LHT和NAT。因此,有人建議添加超聲來診斷LHT(4,24)。在這項研究中,我們只包括明確的LHT病變患者(由兩名不同的調查人員通過觸診和超聲確認),但是需要進一步的工作來正式解決超聲的有用性以診斷LHT或監測病變的變化。
除了只包括由超聲確認的可觸及的LHT病變的患者外,研究的優點還包括使用現代方法,例如等葡萄糖鉗和實驗程序的嚴格標準化。這項研究的限制可能是相對較小的樣本大小(13名患者),特別是在MMTT中,其中每個NAT和LHT區域只包括一次注射。此外,將葡萄糖鉗的結果轉換為臨床實踐總是很困難。這是將進餐測試添加到研究設計的原因之一。我們承認,MMTT期間基線條件的高標準化與患者的日常生活並不直接可比,因此需要進行更大的“真實世界”臨床研究來進一步量化LHT對臨床結果的影響。此外,還需要進行研究以調查LHT是否也影響通過胰島素泵注射的基礎和膺擊胰島素的PK / PD效應,因為泵用戶的LHT發生率和影響的數據很少(1)。注入胰島素的相似效應可能會影響封閉環人工胰臟的有效性。這項研究的另一個限制是在鉗和MMTT期間重複胰島素劑量的應用。這樣做是為了避免受試者多次造訪研究地點,但可能導致每次注射之前的基線條件略有不同,特別是在MMTT期間。儘管第一次劑量是在至少10小時的禁食期後進行的,第二次劑量通常是在第一次測試餐後“僅”6小時內進行的。儘管如此,儘管不能排除由於不同的餵食條件而引起的偏見,但這應該會低估PK和PD的觀察差異。我們還隨機化了MMTT中區域注射的順序。
總之,lispro注入LHT會在等葡萄糖鉗中導致胰島素吸收和作用的重大損害和增加的可變性,MMTTs證實了餐後BG控制的持續惡化。我們的發現的重要性強調了教育患者正確注射技巧的重要性,以及防止和避免所有胰島素注射的LHT。
臨床試驗註冊編號EudraCT2014-003144-12,http://eudract.ema.europa.eu/。
文章資訊
致謝。作者非常感謝參與此項研究的所有患者。此外,作者感謝Profil的研究團隊和臨床人員,由Dr. Leszek Nosek領導,他們付出了巨大的努力。
資金。本研究由Becton, Dickinson and Company(BD, Franklin Lakes, NJ)的研究補助金資助。BD的L.Hi.向Profil的L.Hei.和T.H.提出了對NAT和LAT中胰島素注射的PD比較的想法。研究設計是BD和Profil之間的科學合作開發的。
BD在研究執行、分析、資料解釋或決定提交結果方面沒有任何作用,但L.Hi.對手稿做出了重大的科學貢獻。
利益衝突。L.Hei.和T.H.是Profil的股東。該機構收到了來自AstraZeneca、Novartis、Boehringer Ingelheim、Eli Lilly and Company、Biocon、Adocia、BD、Medtronic、Senseonics、Sanofi和Novo Nordisk A/S的研究補助金。此外,T.H.還從Novo Nordisk A/S、Mylan和Eli Lilly and Company收到了演講諮詢費或旅行補助金。L.Hi.受雇於BD並持有BD的股票或期權。沒有報告與本文相關的其他潛在利益衝突。
作者貢獻。S.F. 撰寫了研究方案,對本研究的數據獲取和解釋做出了重大貢獻,並撰寫了手稿的初稿。U.H. 撰寫了研究方案,並對本研究的數據獲取和解釋做出了重大貢獻。A.F. 主要負責數據分析。H.-V.C.,L.Her.,M.K. 和 L.K. 對本研究的數據獲取做出了重大貢獻。L.Hei. 和 L.Hi. 對本研究的設計和數據解釋做出了重大貢獻。T.H. 對本研究的設計和數據解釋做出了重大貢獻,並撰寫了手稿的後續草稿。所有作者修訂了手稿的實質內容,並批准了要出版的版本。所有作者同意對工作的所有方面承擔責任,確保與工作的任何部分的準確性或完整性有關的問題得到適當的調查和解決。L.Hei.,T.H. 和 L.Hi. 是此項工作的保證人,因此,可以完全訪問研究中的所有數據,並對數據的完整性和數據分析的準確性承擔責任。
先前展示。本研究曾在2015年6月5日至9日於美國波士頓舉行的美國糖尿病協會第75屆科學研討會上,以及2015年9月14日至18日在瑞典斯德哥爾摩舉行的歐洲糖尿病研究協會第51屆年會上展示。
參考文獻
1.Heinemann L. Insulin absorption from lipodystrophic areas: a (neglected) source of trouble for insulin therapy? J Diabetes Sci Technol 2010;4:750–753[PubMed]Google ScholarCrossref
2.Hauner H, Stockamp B, Haastert B. Prevalence of lipohypertrophy in insulin-treated diabetic patients and predisposing factors. Exp Clin Endocrinol Diabetes 1996;104:106–110[PubMed]Google ScholarCrossref
3.Seyoum B, Abdulkadir J. Systematic inspection of insulin injection sites for local complications related to incorrect injection technique. Trop Doct 1996;26:159–161[PubMed]Google ScholarCrossref
4.Blanco M, Hernández MT, Strauss KW, Amaya M. Prevalence and risk factors of lipohypertrophy in insulin-injecting patients with diabetes. Diabetes Metab 2013;39:445–453[PubMed]Google ScholarCrossref
5.Vardar B, Kizilci S. Incidence of lipohypertrophy in diabetic patients and a study of influencing factors. Diabetes Res Clin Pract 2007;77:231–236[PubMed]Google ScholarCrossref
6.Chowdhury TA, Escudier V. Poor glycaemic control caused by insulin induced lipohypertrophy. BMJ 2003;327:383–384[PubMed]Google ScholarCrossref
7.Overland J, Molyneaux L, Tewari S, et al. Lipohypertrophy: does it matter in daily life? A study using a continuous glucose monitoring system. Diabetes Obes Metab 2009;11:460–463[PubMed]Google ScholarCrossref
8.Johansson UB, Amsberg S, Hannerz L, et al. Impaired absorption of insulin aspart from lipohypertrophic injection sites. Diabetes Care 2005;28:2025–2027[PubMed]Google ScholarCrossref
9.Heise T, Nosek L, Bøttcher SG, Hastrup H, Haahr H. Ultra-long-acting insulin degludec has a flat and stable glucose-lowering effect in type 2 diabetes. Diabetes Obes Metab 2012;14:944–950[PubMed]Google ScholarCrossref
10.Heinemann L, Weyer C, Rauhaus M, Heinrichs S, Heise T. Variability of the metabolic effect of soluble insulin and the rapid-acting insulin analog insulin aspart. Diabetes Care 1998;21:1910–1914[PubMed]Google ScholarCrossref
11.Becker RH, Nowotny I, Teichert L, Bergmann K, Kapitza C. Low within- and between-day variability in exposure to new insulin glargine 300 U/ml. Diabetes Obes Metab 2015;17:261–267[PubMed]Google ScholarCrossref
12.Young RJ, Hannan WJ, Frier BM, Steel JM, Duncan LJ. Diabetic lipohypertrophy delays insulin absorption. Diabetes Care 1984;7:479–480[PubMed]Google ScholarCrossref
13.Fujikura J, Fujimoto M, Yasue S, et al. Insulin-induced lipohypertrophy: report of a case with histopathology. Endocr J 2005;52:623–628[PubMed]Google ScholarCrossref
14.Wallymahmed ME, Littler P, Clegg C, Haqqani MT, Macfarlane IA. Nodules of fibrocollagenous scar tissue induced by subcutaneous insulin injections: a cause of poor diabetic control. Postgrad Med J 2004;80:732–733[PubMed]Google ScholarCrossref
15.Grassi G, Scuntero P, Treppicioni R, Marubbi F, Strauss K. Optimizing insulin injection technique and its effect on blood glucose control. J Clin Transl Endocrinol 2014;1:145–150
Google Scholar
16.Sun Z, Li Q, Ji L, et al. Lipohypertrophy: prevalence, risk factors, clinical characteristics, and economic burden of insulin-requiring patients in China. Diabetologia 2015;58(Suppl. 1):S438–S439
Google Scholar
17.Becker RHA. Pharmacodynamic evaluation: diabetes methodologies. In Drug Discovery and Evaluation: Methods in Clinical Pharmacology. Vogel HG, Maas J, Gebauer A, Eds. Berlin, Heidelberg, Springer-Verlag, 2011, p. 457–481
18.Vora J, Heise T. Variability of glucose-lowering effect as a limiting factor in optimizing basal insulin therapy: a review. Diabetes Obes Metab 2013;15:701–712[PubMed]Google ScholarCrossref
19.Cox DJ, Gonder-Frederick L, Ritterband L, Clarke W, Kovatchev BP. Prediction of severe hypoglycemia. Diabetes Care 2007;30:1370–1373[PubMed]Google ScholarCrossref
20.McCall AL, Kovatchev BP. The median is not the only message: a clinician’s perspective on mathematical analysis of glycemic variability and modeling in diabetes mellitus. J Diabetes Sci Technol 2009;3:3–11[PubMed]Google ScholarCrossref
21.Trayhurn P, Wood IS. Adipokines: inflammation and the pleiotropic role of white adipose tissue. Br J Nutr 2004;92:347–355[PubMed]Google ScholarCrossref
22.Spencer M, Unal R, Zhu B, et al. Adipose tissue extracellular matrix and vascular abnormalities in obesity and insulin resistance. J Clin Endocrinol Metab 2011;96:E1990–E1998[PubMed]Google ScholarCrossref
23.Pasarica M, Sereda OR, Redman LM, et al. Reduced adipose tissue oxygenation in human obesity: evidence for rarefaction, macrophage chemotaxis, and inflammation without an angiogenic response. Diabetes 2009;58:718–725[PubMed]Google ScholarCrossref
24.Perciun R. Ultrasonographic aspect of subcutaneous tissue dystrophies as a result of insulin injections. Med Ultrason 2010;12:104–109[PubMed]Google Scholar



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย