本翻譯僅作學術交流用,無商業意圖,請勿轉載,如有疑議問請來信
研究發現,內臟脂肪透過分泌炎症相關脂肪因子進入門靜脈,是造成肥胖人群系統性發炎的重要原因。在25名極度肥胖受試者(平均體質指數54.7 ± 12.6 kg/m²)中,比較門靜脈和桡動脈中的血液樣本發現,門靜脈中的白介素6(IL-6)濃度顯著高於桡動脈中的濃度(約高出50%),而白介素6濃度與全身C反應蛋白濃度正相關。這些結果提供了內臟脂肪與系統性發炎之間潛在機制的初步證據,指出減少腹部肥胖可能對減輕系統性發炎及其相關代謝異常有重要的意義。
Luigi Fontana; J. Christopher Eagon; Maria E. Trujillo; Philipp E. Scherer; Samuel Klein
Crossmark: Check for Updates
Address correspondence and reprint requests to Samuel Klein, MD, Washington University School of Medicine, Campus Box 8031, 660 South Euclid Ave., St. Louis, MO 63110. E-mail: sklein@im.wustl.edu
Diabetes 2007;56(4):1010–1013
Article history
PubMed: 17287468
https://doi.org/10.2337/db06-1656
Although excess visceral fat is associated with noninfectious inflammation, it is not clear whether visceral fat is simply associated with or actually causes metabolic disease in humans. To evaluate the hypothesis that visceral fat promotes systemic inflammation by secreting inflammatory adipokines into the portal circulation that drains visceral fat, we determined adipokine arteriovenous concentration differences across visceral fat, by obtaining portal vein and radial artery blood samples, in 25 extremely obese subjects (mean ± SD BMI 54.7 ± 12.6 kg/m2) during gastric bypass surgery at Barnes-Jewish Hospital in St. Louis, Missouri. Mean plasma interleukin (IL)-6 concentration was ∼50% greater in the portal vein than in the radial artery in obese subjects (P = 0.007). Portal vein IL-6 concentration correlated directly with systemic C-reactive protein concentrations (r = 0.544, P = 0.005). Mean plasma leptin concentration was ∼20% lower in the portal vein than in the radial artery in obese subjects (P = 0.0002). Plasma tumor necrosis factor-α, resistin, macrophage chemoattractant protein-1, and adiponectin concentrations were similar in the portal vein and radial artery in obese subjects. These data suggest that visceral fat is an important site for IL-6 secretion and provide a potential mechanistic link between visceral fat and systemic inflammation in people with abdominal obesity.
雖然過多的內臟脂肪與非感染性發炎有關,但目前尚不清楚內臟脂肪是否僅僅與代謝性疾病有關還是實際上導致了人類的代謝性疾病。為了評估這樣一個假設,即內臟脂肪通過分泌炎症性脂肪因子進入引流內臟脂肪的門靜脈循環來促進系統性發炎,我們在密蘇里州聖路易斯的巴恩斯-猶太醫院進行了胃旁路手術的過程中,通過獲取門靜脈和桡動脈血液樣本,測定了內臟脂肪周圍的脂肪因子動脈靜脈濃度差異,在25名極度肥胖的受試者中(平均±標準差BMI為54.7±12.6 kg/m2)。結果顯示,肥胖者門靜脈的平均血漿白細胞介素(IL)-6濃度比桡動脈高約50%(P = 0.007)。門靜脈IL-6濃度與全身C-反應蛋白濃度呈正相關(r = 0.544,P = 0.005)。肥胖者門靜脈的平均血漿瘦素濃度比桡動脈低約20%(P = 0.0002)。肥胖者門靜脈和桡動脈的血漿腫瘤壞死因子-α、抗抗力素、巨噬細胞趨化蛋白-1和脂聯素濃度相似。這些數據表明,內臟脂肪是IL-6分泌的重要部位,並為腹部肥胖者中的內臟脂肪和系統性發炎之間提供了可能的機制聯繫。
過多的內臟脂肪(即腸系膜和大網膜脂肪)與胰島素抵抗和糖尿病相關聯(1,2)。因此,腰圍與內臟脂肪量呈相關(3),已被推薦作為識別代謝性疾病風險增加患者的臨床標誌(4),並且較大的腰圍是診斷代謝綜合徵的標準之一(5)。然而,內臟脂肪與代謝異常之間關係的機制尚不清楚,也不清楚內臟脂肪是否僅僅與代謝性疾病相關還是實際上導致代謝性疾病。
有假設認為大量的內臟脂肪會引起胰島素抵抗,因為內臟脂肪組織三酸甘油酯的脂解會將游離脂肪酸(FFA)直接釋放到門靜脈中,然後運送到肝臟(2)。FFA向肝臟的增加輸送會影響胰島素抑制肝糖生成的能力,而全身FFA濃度的增加則抑制胰島素介導的骨骼肌葡萄糖處理(6)。然而,對人體受試者進行FFA動力學研究的數據表明,內臟脂肪的脂解活動不太可能是胰島素抵抗的主要因素(7)。在肥胖者中,平均有20%的門靜脈FFA和14%的出現在系統循環中的總FFA來自內臟脂肪的脂解(7,8)。因此,內臟脂肪釋放的脂肪酸只占總FFA輸送到肝臟和肌肉組織中的一小部分。
內臟脂肪可能通過分泌炎性脂肪因子,如白細胞介素(IL)-6、腫瘤壞死因子-α(TNF-α)、巨噬細胞趨化蛋白-1(MCP-1)和抗抗力素,引起胰島素抵抗和糖尿病(9,10)。相反,內臟脂肪可能通過產生脂聯素(11)具有有益的代謝效應,脂聯素能增加胰島素敏感性,降低葡萄糖不耐受和糖尿病(12)。然而,對肥胖相關代謝異常的發病機制中內臟脂肪產生脂肪因子的重要性尚未受到仔細研究。
本研究的目的是評估在具有腹部肥胖的胰島素抵抗者中,內臟脂肪分泌炎性脂肪因子(IL-6、TNF-α、MCP-1、抗抗力素和瘦素)和脂聯素的相對貢獻。我們測定了大量內臟脂肪的胰島靜脈和周邊動脈的脂肪因子血漿濃度。我們假設在肥胖者中,炎性脂肪因子的濃度在門靜脈中會比在周邊動脈中更高。
研究設計與方法
本研究納入了25名患有III級上半身肥胖的受試者(6名男性和19名女性,BMI為54.7 ± 12.6 kg/m2,腰圍為150 ± 10 cm,年齡為42 ± 9歲),這些受試者預定接受開腹胃繞道手術。受試者完成了全面的醫學評估,包括病史、體格檢查、心電圖以及標準的血液和尿液檢查。所有肥胖受試者都有胰島素抵抗的證據,根據2型糖尿病病史或高的家庭ostasis模型評估分數(13)。所有參與本研究的女性都是更年期前的。其中6名肥胖者患有2型糖尿病,並接受胰島素和二甲双胍治療;沒有人接受胰島素增敏劑的治療。在參加本研究之前,每名受試者均提供書面知情同意書,該研究獲得了密蘇里州聖路易斯華盛頓大學醫學院人體研究委員會的批准。
開腹胃繞道手術和上消化道手術在Barnes-Jewish醫院的早上進行,患者在過夜禁食後進行。手術期間,在開始胃縫合或腸道切除之前,同時從橈骨動脈和門靜脈獲取血液樣本。血液樣本立即轉移到無菌玻璃EDTA管中(BD Vacutainer;BD Biosciences,英國牛津),置於冰上,並在4°C下以2,200g離心10分鐘。然後,將血漿等份裝入無菌冷凍管中,用液氮迅速冷凍,並儲存在-80°C,直到進行後續分析。
樣本分析
使用商業放射免疫法試劑盒測量血漿總脂聯素(Linco Research, St. Louis, MO),使用商業酶聯免疫法試劑盒測量IL-6、TNF-α、抗抗力素、MCP-1(Quantakine High Sensitive; R&D Systems, Minneapolis, MN)和血漿C-反應蛋白(CRP)(ALPCO Diagnostics, Windham, NH)濃度。使用速度沉降和定量Western blot分析(14)確定了血漿高分子量(HMW)和低分子量(LMW)脂聯素。血漿胰島素和瘦素濃度通過放射免疫法測量(Linco Research, St. Louis, MO)。
統計分析
對於正常分佈且標準差近似相等的數據,使用Student’s配對t檢驗評估血液採樣部位之間的差異的統計學顯著性。對於不正常分佈或具有不等的標準差的組之間的差異,使用Wilcoxon雙樣本檢驗評估變量的統計學顯著性。使用Pearson相關性分析連續變量之間的關聯。當數據不正常分佈時,將相關數據進行對數轉換。 P值<0.05被認為是統計學上顯著的。所有數據均使用SPSS for Windows軟件進行分析,版本為12.0(SPSS,芝加哥,IL)。所有數值均表示為均值±標準差。
結果
在開腹胃繞道手術期間,從25名極度肥胖(BMI為54.7 ± 12.6 kg/m2)且擁有大量內臟脂肪的受試者身上同時獲得了門靜脈和橈骨動脈的血液樣本。所有肥胖受試者根據胰島素抵抗的家庭ostasis模型評估而確定存在胰島素抵抗(13)。
在肥胖受試者中,門靜脈血漿胰島素濃度比外周動脈高出兩倍以上(分別為34.4 ± 21和15.2 ± 8 μU/ml;P = 0.0004)。門靜脈血漿IL-6濃度比外周動脈高出約50%(表1)。門靜脈血漿瘦素濃度比外周動脈低約20%。相比之下,門靜脈血漿TNF-α、MCP-1、抗抗力素和總脂聯素濃度與外周動脈濃度沒有顯著差異。在一部分10名肥胖受試者中評估了門靜脈和橈骨動脈中高分子量(HMW)脂聯素的存在百分比;發現門靜脈(33.1 ± 11%)和動脈(28.6 ± 17%)之間HMW脂聯素的存在百分比沒有顯著差異。門靜脈IL-6濃度與動脈CRP濃度呈正相關(圖1)。
討論
由於在人體中獲取門靜脈血液樣本具有一定的困難,因此從內臟脂肪釋放的脂聯素對胰島素抵抗和全身性炎症的發病機制在人體中尚未得到深入研究。門靜脈是內臟脂肪的排水輸送主要來源,負責大約80%的肝臟血液供應(15)。在本研究中,我們在患有大量腹部脂肪的極度肥胖受試者進行開放性胃繞道手術期間從門靜脈和橈骨動脈獲得了血液樣本。在肥胖受試者中,門靜脈血漿IL-6濃度遠高於外周動脈血液,表明內臟脂肪是肥胖人群中IL-6產生的重要來源。這些數據與先前的體外發現相一致,即內臟脂肪組織中的IL-6分泌量高於皮下脂肪組織樣本(16,17)。此外,門靜脈IL-6濃度與肥胖受試者的動脈CRP濃度呈正相關。這些結果首次提供了人體中內臟脂肪量與全身性炎症之間可能存在的潛在機制聯繫的證據。
IL-6直接分泌到門靜脈具有重要的代謝後果,因為IL-6刺激肝臟急性期反應物的產生(18),損害胰島素調節的糖原合成(19),並刺激肝臟糖新生(20)。血清IL-6濃度升高也與發展2型糖尿病和心血管疾病的風險增加相關(21–23)。在我們的肥胖受試者中,門靜脈IL-6濃度與全身性CRP濃度呈直接正相關,表明IL-6進入肝臟有助於調節CRP的產生。這一觀察結果提供了內臟脂肪與全身性胰島素抵抗之間關係的潛在機制,並支持了內臟脂肪參與調節肝臟急性期反應物產生的可能性,進而激活炎症途徑(24)。這些發現與LIKK小鼠的數據一致,該數據顯示肝臟中核因子-κB和炎症的局部增加可以導致肌肉外周胰島素抵抗(25)。此外,我們先前發現在體內皮下腹部脂肪中存在大量IL-6的淨釋放,並且在肥胖者中此釋放比瘦人更多(26)。因此,在基礎條件下,肥胖人的內臟和皮下脂肪沉積都會產生大部分循環IL-6。
在我們的受試者中,門靜脈瘦素濃度低於外周動脈血液。門靜脈瘦素濃度較低與體外分離的脂肪組織數據一致,該數據表明產生瘦素的ob基因表達和瘦素分泌在大網膜和皮下脂肪中較低(27,28)。
與IL-6和瘦素相比,其他潛在的炎症性脂聯素(如TNF-α和抗抗素)的血漿濃度在門靜脈和外周動脈中相似。根據已知的這些脂聯素的產生和分解情況,這些結果並不令人驚訝。儘管TNF-α的產生在內臟脂肪中上調(29),但這種細胞因子可能主要在局部起作用,並且並非主要釋放到血液中。事實上,我們先前發現體內皮下腹部脂肪中不存在TNF-α的淨釋放(26)。在小鼠中,抗抗素僅由脂肪細胞產生(30),但在人類中,抗抗素的表達在單核細胞和巨噬細胞中更為突出(31)。脂聯素主要以LMW六聚體和較大的、多聚體的HMW複合物形式循環於血漿中(32)。HMW蛋白,而不是LMW形式,通過增加肝臟胰島素敏感性並降低肝臟葡萄糖生成,對肝臟具有直接的有益代謝效應(33–34)。此外,治療重組脂聯素已被證明可以減少非酒精性脂肪肝小鼠模型中的肝臟肥大、脂肪肝、肝臟炎症和血清轉氨酶濃度(35)。因此,內臟脂肪對HMW脂聯素的優選產生可能對肝臟具有直接的有益代謝效應,這可能不會僅通過測量總脂聯素濃度來識別。然而,我們發現門靜脈和全身的總、HMW或LMW脂聯素濃度之間沒有差異。這些結果表明,內臟脂肪不是脂聯素產生的主要部位。
在肥胖受試者中,門靜脈中的空腹血漿胰島素濃度比外周動脈血液中的濃度高出兩倍以上,與先前報導的數據一致(36)。這一觀察結果突顯了胰臟和內臟脂肪作為調節肝臟葡萄糖和脂肪代謝的內分泌器官的重要解剖位置。這兩種組織都由門靜脈循環排出,這提供了一個有效的系統,將蛋白質激素(如胰島素)和炎症性細胞因子(如IL-6)直接運送到肝臟,從而調節內源性葡萄糖生成和急性期炎症反應物的產生。
我們的研究存在幾個重要的限制。首先,它是在受試者進行吸收後狀態下進行的,這可能不反映脂肪組織脂聯素在進食後狀態下分泌到全身或門靜脈循環的情況。其次,血液樣本是在手術期間獲得的,這可能會影響血漿脂聯素濃度。全身麻醉可以減少門靜脈血流量(37),這可能會增加門靜脈脂聯素濃度。然而,血流量的減少應同時影響所有由內臟脂肪分泌的脂聯素,但我們發現門靜脈IL-6濃度高於橈骨動脈血液,而瘦素濃度則低於橈骨動脈血液。第三,我們的研究對象僅限於極度肥胖的受試者(BMI >40 kg/m2),他們擁有大量的腹部脂肪。因此,這些結果可能不一定適用於BMI值較低且內臟脂肪量較少的肥胖者。但是,我們沒有發現BMI或腰圍與門靜脈或動脈脂聯素濃度之間存在顯著相關。第四,我們觀察到的門靜脈IL-6和全身性CRP濃度之間的關聯性並不能證明因果關係。需要進行額外且非常復雜的研究,包括門靜脈注入IL-6抑制劑和重組門靜脈IL-6,以證明門靜脈IL-6是CRP產生的主要調節因素。
本研究的結果支持了內臟脂肪是參與肥胖和全身性炎症之間復雜相互作用的重要內分泌器官的觀點。我們的研究結果表明,內臟脂肪增加的IL-6分泌進入門靜脈循環參與了與腹部肥胖相關的全身性代謝異常的發病機制。
圖1。 極度肥胖受試者門靜脈IL-6與全身CRP濃度之間的關係。數據已進行對數轉換。 表1 肥胖受試者的桡动脉和门静脉血浆脂联素浓度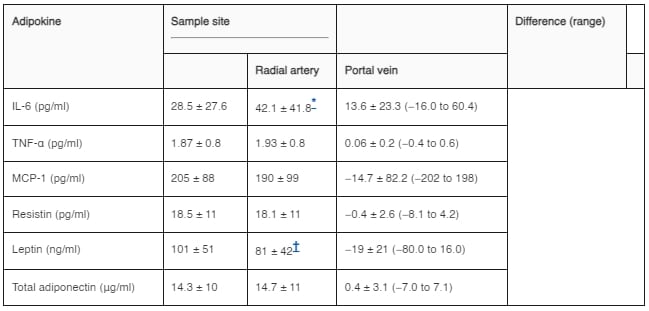
參考文獻
1.Montague CT, O’Rahilly S: The perils of portliness: causes and consequences of visceral adiposity. Diabetes 49: 883–888,2000
2.Despres JP, Moorjani S, Lupien PJ, Tremblay A, Nadeau A, Bouchard C: Regional distribution of body fat, plasma lipoproteins, and cardiovascular disease. Arteriosclerosis 10: 497–511,1990
3.Pouliot MC, Despres JP, Lemieux S, Moorjani S, Bouchard C, Tremblay A, Nadeau A, Lupien PJ: Waist circumference and abdominal sagittal diameter: best simple anthropometric indexes of abdominal visceral adipose tissue accumulation and related cardiovascular risk in men and women. Am J Cardiol 73: 460–468,1994
4.Zhu S, Wang Z, Heshka S, Heo M, Faith MS, Heymsfield SB: Waist circumference and obesity-associated risk factors among whites in the third National Health and Nutrition Examination Survey: clinical action thresholds. Am J Clin Nutr 76: 743–749,2002
5.Grundy SM, Brewer HB Jr, Cleeman JI, Smith SC Jr, Lenfant C, National Heart, Lung, and Blood Institute, American Heart Association: Definition of metabolic syndrome: report of the National Heart, Lung, and Blood Institute/American Heart Association conference on scientific issues related to definition. Circulation 109: 433–438,2004
6.Boden G: Role of fatty acids in the pathogenesis of insulin resistance and NIDDM. Diabetes 46: 3–10,1997
7.Nielsen S, Guo ZK, Johnson CM, Hensrud DD, Jensen MD: Splanchnic lipolysis in human obesity. J Clin Invest 113: 1582–1588,2004
8.Klein S: The case of visceral fat: argument for the defense. J Clin Invest 113: 1530–1532,2004
9.Lafontan M: Fat cells: afferent and efferent messages define new approaches to treat obesity. Annu Rev Pharmacol Toxicol 45: 119–146,2004
10.Xu H, Barnes GT, Yang Q, Tan G, Yang D, Chou CJ, Sole J, Nichols A, Ross JS, Tartaglia LA, Chen H: Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance. J Clin Invest 112: 1821–1830,2003
11.Park KG, Park KS, Kim MJ, Kim HS, Suh YS, Ahn JD, Park KK, Chang YC, Lee IK: Relationship between serum adiponectin and leptin concentrations and body fat distribution. Diabetes Res Clin Pract 63: 135–142,2004
12.Trujillo ME, Scherer PE: Adiponectin: journey from an adipocyte secretory protein to biomarker of the metabolic syndrome. J Intern Med 257: 167–175,2005
13.Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC: Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 28: 412–419,1985
14.Pajvani UB, Du X, Combs TP, Berg AH, Rajala MW, Schulthess T, Engel J, Brownlee M, Scherer PE: Structure-function studies of the adipocyte-secreted hormone Acrp30/adiponectin: implications fpr metabolic regulation and bioactivity. J Biol Chem 278: 9073–9085,2003
15.Schenk WG Jr, Mcdonald JC, Mcdonald K, Drapanas T: Direct measurement of hepatic blood flow in surgical patients: with related observations on hepatic flow dynamics in experimental animals. Ann Surg 156: 463–471,1962
16.Fried SK, Bunkin DA, Greenberg AS: Omental and subcutaneous adipose tissues of obese subjects release interleukin-6: depot difference and regulation by glucocorticoid. J Clin Endocrinol Metab 83: 847–850,1998
17.Fain JN, Madan AK, Hiler ML, Cheema P, Bahouth SW: Comparison of the release of adipokines by adipose tissue, adipose tissue matrix, and adipocytes from visceral and subcutaneous abdominal adipose tissues of obese humans. Endocrinology 145: 2273–2282,2004
18.Heinrich PC, Castell JV, Andus T: Interleukin-6 and the acute phase response. Biochem J 265: 621–636,1990
19.Senn JJ, Klover PJ, Nowak IA, Mooney RA: Interleukin-6 induces cellular insulin resistance in hepatocytes. Diabetes 51: 3391–3399,2002
20.Tsigos C, Papanicolaou DA, Kyrou I, Defensor R, Mitsiadis CS, Chrousos GP: Dose dependent effects of recombinant human interleukin-6 on glucose regulation. J Clin Endocrinol Metab 82: 4167–4170,1997
21.Pickup JC, Mattock MB, Chusney GD, Burt D: NIDDM as a disease of the innate immune system: association of acute-phase reactants and interleukin-6 with metabolic syndrome X. Diabetologia 40: 1286–1292,1997
22.Pradhan AD, Manson JE, Rifai N, Buring JE, Ridker PM: C-reactive protein, interleukin 6, and risk of developing type 2 diabetes mellitus. JAMA 286: 327–334,2001
23.Plutzky J: Inflammatory pathways in atherosclerosis and acute coronary syndromes. Am J Cardiol 88: 10K–15K,2001
24.Bisoendial RJ, Kastelein JJ, Levels JH, Zwaginga JJ, van den Bogaard B, Reitsma PH, Meijers JC, Hartman D, Levi M, Stroes ES: Activation of inflammation and coagulation after infusion of C-reactive protein in humans. Circ Res 96: 714–716,2005
25.Cai D, Yuan M, Frantz DF, Melendez PA, Hansen L, Lee J, Shoelson SE: Local and systemic insulin resistance resulting from hepatic activation of IKK-beta and NF-kappaB. Nat Med 11: 183–190,2005
26.Mohamed-Ali V, Goodrick SJ, Rawesh A, Katz DR, Miles JM, Yudkin JS, Klein S, Coppack SW: Subcutaneous adipose tissue releases interleukin-6 but not tumor necrosis factor-alpha in vivo. J Clin Endocrinol Metab 82: 4196–4200,1997
27.Ramis JM, Bibiloni B, Moreiro J, Garcia-Sanz JM, Salinas R, Proenza AM, Llado I: Tissue leptin and plasma insulin are associated with lipoprotein lipase activity in severely obese patients. J Nutr Biochem 16: 279–285,2005
28.Van Harmelen V, Reynisdottir S, Eriksson P, Thorne A, Hoffstedt J, Lonnqvist F, Arner P: Leptin secretion from subcutaneous and visceral adipose tissue in women. Diabetes 47: 913–917,1998
29.Hotamisligil GS, Arner P, Caro JF, Atkinson RL, Spiegelman BM: Increased adipose tissue expression of tumor necrosis factor-alpha in human obesity and insulin resistance. J Clin Invest 95: 2409–2415,1995
30.Steppan CM, Bailey ST, Bhat S, Brown EJ, Banerjee RR, Wright CM, Patel HR, Ahima RS, Lazar MA: The hormone resistin links obesity to diabetes. Nature 409: 307–312,2001
31.Patel L, Buckels AC, Kinghorn IJ, Murdock PR, Holbrook JD, Plumpton C, Macphee CH, Smith SA: Resistin is expressed in human macrophages and directly regulated by PPAR gamma activators. Biochem Biophys Res Commun 300: 472–476,2003
32.Pajvani UB, Du X, Combs TP, Berg AH, Rajala MW, Schulthess T, Engel J, Brownlee M, Scherer PE: Complex distribution, not absolute amount of adiponectin, correlates with thiazolidinedione-mediated improvement in insulin sensitivity. J Biol Chem 279: 12152–12162,2004
33.Cote M, Mauriege P, Bergeron J, Almeras N, Tremblay A, Lemieux I, Despres JP: Adiponectinemia in visceral obesity: impact on glucose tolerance and plasma lipoprotein and lipid levels in men. J Clin Endocrinol Metab 90: 1434–1439,2005
34.Berg AH, Combs TP, Du X, Brownlee M, Scherer PE: The adipocyte-secreted protein Acrp30 enhances hepatic insulin action. Nat Med 7: 947–953,2001
35.Xu A, Wang Y, Keshaw H, Xu LY, Lam KSL, Cooper GJS: The fat-derived hormone adiponectin alleviates alcoholic and nonalcoholic fatty liver disease in mice. J Clin Invest 112: 91–100,2003
36.Horwitz DL, Starr JI, Mako ME, Blackard WG, Rubenstein AH: Proinsulin, insulin, and C-peptide concentrations in human portal and peripheral blood. J Clin Invest 55: 1278–1283,1975
37.Gelman S: General anesthesia and hepatic circulation. Can J Physiol Pharmacol 65: 1762–1779,1987



 English
English Bahasa Melayu
Bahasa Melayu Bahasa Indonesia
Bahasa Indonesia Tiếng Việt
Tiếng Việt ไทย
ไทย